题目内容
已知下列反应:Cu+2Fe3+═Cu2++2Fe2+.现取Cu与Fe2O3的混合物22.4g与过量的稀硫酸反应.若要使固体混合物完全溶解,且所消耗的H2SO4的物质的量最少,则混合物中铜的质量为( )
| A、3.2g | B、6.4g |
| C、9.6g | D、12.8g |
考点:化学方程式的有关计算
专题:计算题
分析:使固体混合物完全溶解,且所消耗的H2SO4的物质的量最少,则生成CuSO4、FeSO4,由Cu+2Fe3+═Cu2++2Fe2+,可知Cu与Fe2O3的物质的量为1:1,结合二者质量计算物质的量,再根据m=nM计算Cu的质量.
解答:
解:使固体混合物完全溶解,且所消耗的H2SO4的物质的量最少,则生成CuSO4、FeSO4,由Cu+2Fe3+═Cu2++2Fe2+,可知Cu与Fe2O3的物质的量为1:1,则Cu的物质的量为
=0.1mol,故混合物中Cu的质量为0.1mol×64g/mol=6.4g,故选B.
| 22.4g |
| 64g/mol+160g/mol |
点评:本题考查混合物计算,难度中等,判断产物确定铜与氧化铁的物质的量关系是关键.

练习册系列答案
 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案
相关题目
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )

| A、该试剂的物质的量浓度为9.2mol?L-1 |
| B、该硫酸50mL与足量的铜反应可得到标准状况下0.46mol气体 |
| C、配制200mL 4.6mol?L-1的稀硫酸需取该硫酸50mL |
| D、该硫酸与等体积的水混合所得溶液的质量分数小于49% |
 在25℃时,用0.125mol?L-1的标准盐酸滴定25.00mL未知浓度的NaOH溶液所得滴定曲线如图所示,图中K点代表的pH为( )
在25℃时,用0.125mol?L-1的标准盐酸滴定25.00mL未知浓度的NaOH溶液所得滴定曲线如图所示,图中K点代表的pH为( )| A、13 | B、12 | C、10 | D、11 |
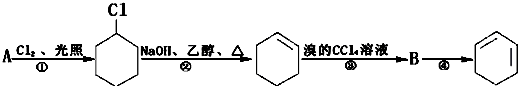
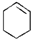 具有的性质叙述正确的是
具有的性质叙述正确的是