题目内容
7.下列离子方程式的书写正确的是( )| A. | 漂白粉溶液中通入SO2气体 Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| B. | 碳酸氢钙溶液中加入过量的氢氧化钠溶液 HCO3-+OH-═CO32-+H2O | |
| C. | 明矾溶液中加入过量的Ba(OH)2溶液2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓ | |
| D. | 过量的NH4HSO4溶液与Ba(OH)2溶液反应2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
分析 A.次氯酸具有强氧化性,能够将亚硫酸钙氧化成硫酸钙;
B.氢氧化钠溶液过量,反应生成碳酸钙沉淀、碳酸钠和水;
C.氢氧化钡过量,反应生成硫酸钡沉淀、水和偏铝酸钠;
D.硫酸氢铵过量,铵根离子不参与反应,反应生成硫酸铵、硫酸钡沉淀和水.
解答 解:A.SO2通入漂白粉溶液,发生氧化还原反应,正确的离子方程式为:SO2+Ca2++ClO-+H2O=CaSO4↓+2H++Cl-,故A错误;
B.Ca(HCO3)2溶液与足量NaOH溶液反应生成碳酸钙沉淀、碳酸钠和水,反应的离子方程式为:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+H2O,故B错误;
C.明矾溶液中加入过量的Ba(OH)2溶液,反应生成硫酸钡沉淀、偏铝酸钠和水,正确的离子方程式为:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O,故C错误;
D.过量的NH4HSO4溶液与Ba(OH)2溶液反应生成硫酸铵、硫酸钡和水,反应的离子方程式为:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O,故D正确;
故选D.
点评 本题考查了离子方程式的正误判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
相关题目
17.已知铋(Bi)元素的化合价可表现为+3或+5价.锗酸铋(简称BGO)是我国研制成功的一种性能优良的闪烁晶体材料,其中的锗(Ge)元素为+4价.BGO可看成由锗和铋两种元素的氧化物所形成的复杂化合物,已知在BGO中两种氧化物所含氧的质量相同,则BGO的化学式可能是( )
| A. | Bi3Ge3O15 | B. | Bi3Ge3O12 | C. | Bi4Ge3O16 | D. | Bi4Ge3O12 |
18.区分日常生活中的下列各组物质,两种方法都正确的是( )
| 选项 | 需区分的物质 | 实验方法 |
| A | 白酒和白醋 | ①观察颜色②闻气味 |
| B | 食盐和白糖 | ①加稀盐酸②加水溶解 |
| C | 合成纤维和天然纤维 | ①点燃闻气味②观察色泽 |
| D | 酸性厕所清洁剂与碱性厨房清洁剂 | ①测pH②加石灰石 |
| A. | A | B. | B | C. | C | D. | D |
15.工业上通过反应“SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑”制取单质硅.下列说法正确的是( )
| A. | 自然界中硅元素均以SiO2形式存在 | |
| B. | 高纯度晶体Si可用于制造光导纤维 | |
| C. | 该反应条件下C的还原性比Si强 | |
| D. | 生成4.48LCO时转移电子数为0.4×6.03×1023 |
2.近年以来,我国多地频现种种极端天气,二氧化碳、氮氧化物、二氧化硫是导致极端天气的重要因素.
(1)活性炭可用于处理大气污染物NO,在1L恒容密闭容器中加入0.100mol NO和2.030mol固体活性炭(无杂质),生成气体E和气体F.当温度分别在T1℃和T2℃时,测得平衡时各物质的物质的量如表:
①请结合上表数据,写出NO与活性炭反应的化学方程式C+2NO?N2+CO2.
②上述反应的平衡常数表达式K=$\frac{{c({N_2})•c(C{O_2})}}{{c{{(NO)}^2}}}$,根据上述信息判断,T1和T2的关系是 C .
A.T1>T2 B.T1<T2 C.无法比较
③在T1℃下反应达到平衡后,下列措施能改变NO的转化率的是cd.
a.增大c(NO) b.增大压强 c.升高温度 d.移去部分F
(2)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得H2,具体流程如图1所示:
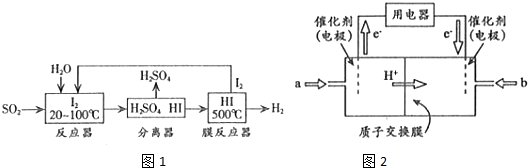
①用离子方程式表示反应器中发生的反应:SO2+I2+2H2O=SO42-+2I-+4H+.
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是HI分解为可逆反应,及时分离出产物H2,有利于反应正向进行 .
(3)开发新能源是解决大气污染的有效途径之一.直接甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图2所示.
通过a气体的电极是原电池的负极(填“正”或“负”),b电极反应式为O2+4e-+4H+=2H2O.
(1)活性炭可用于处理大气污染物NO,在1L恒容密闭容器中加入0.100mol NO和2.030mol固体活性炭(无杂质),生成气体E和气体F.当温度分别在T1℃和T2℃时,测得平衡时各物质的物质的量如表:
| 物质 n/mol T/℃ | 活性炭 | NO | E | F |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
②上述反应的平衡常数表达式K=$\frac{{c({N_2})•c(C{O_2})}}{{c{{(NO)}^2}}}$,根据上述信息判断,T1和T2的关系是 C .
A.T1>T2 B.T1<T2 C.无法比较
③在T1℃下反应达到平衡后,下列措施能改变NO的转化率的是cd.
a.增大c(NO) b.增大压强 c.升高温度 d.移去部分F
(2)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得H2,具体流程如图1所示:

①用离子方程式表示反应器中发生的反应:SO2+I2+2H2O=SO42-+2I-+4H+.
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是HI分解为可逆反应,及时分离出产物H2,有利于反应正向进行 .
(3)开发新能源是解决大气污染的有效途径之一.直接甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图2所示.
通过a气体的电极是原电池的负极(填“正”或“负”),b电极反应式为O2+4e-+4H+=2H2O.
12.下列反应的离子方程式正确的是( )
| A. | Ca(HCO3)2溶液与足量NaOH溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+H2O | |
| B. | 等物质的量的Ba(OH)2与NH4HSO4在稀溶液中反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O | |
| C. | 向100mL 1mol/L FeBr2溶液中通入0.5mol Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | |
| D. | 向澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2=CaCO3↓+H2O |

 ;
;