题目内容
14.下列冶炼金属的反应原理,错误的是( )| A. | 2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑ | B. | MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑ | ||
| C. | 3Fe3O4+8Al$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Fe | D. | Cu+2FeCl3═CuCl2+2FeCl2 |
分析 金属冶炼是工业上将金属从含有金属元素的矿石中还原出来的生产过程.金属的活动性不同,可以采用不同的冶炼方法.
金属冶炼的方法主要有:
热分解法:对于不活泼金属,可以直接用加热分解的方法将金属从其化合物中还原出来(Hg及后边金属);
热还原法:在金属活动性顺序表中处于中间位置的金属,通常是用还原剂(C、CO、H2、活泼金属等)将金属从其化合物中还原出来(Zn~Cu);
电解法:活泼金属较难用还原剂还原,通常采用电解熔融的金属化合物的方法冶炼活泼金属(K~Al).
解答 解:A.钠性质活泼,用电解熔融氯化钠方法制取,故A正确;
B.镁性质活泼,用电解熔融氯化镁方法制取,故B正确;
C.铁熔点高,活泼性弱于铝,可用铝热反应制取,故C正确;
D.铜与氯化铁反应得不到金属,故D错误;
故选:D.
点评 本题考查了冶炼金属的一般方法和原理,明确物质的性质是解题关键,注意活泼性不同的金属冶炼的方法不同,本题难度不大.

练习册系列答案
相关题目
5.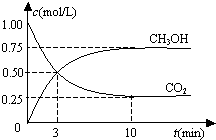 恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:
恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得其中CO2和CH3OH(g)浓度随时间变化如图.下列说法错误的是( )
 恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:
恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得其中CO2和CH3OH(g)浓度随时间变化如图.下列说法错误的是( )
| A. | 该密闭容器的体积为1 L | |
| B. | 反应达平衡,氢气的转化率为0.75 | |
| C. | 反应达平衡,氢气平均反应速率0.075 mol/(L•min) | |
| D. | CO2或H2O物质的量不再改变时反应达平衡 |
9.下列说法正确的是( )
| A. | 自发进行的化学反应不一定是放热反应 | |
| B. | 自发过程将导致体系的熵增大 | |
| C. | △H-T△S<0的反应,不需要任何条件就可自发进行 | |
| D. | 同一物质的气、液、固三种状态的熵值依次增大 |
19.在25℃和1×105Pa 时,将气态物质中的1mol A-B键拆成气态A原子和B原子,所需要的能量称为键能(单位:kJ/mol).下面是一些共价键的键能:
(1)根据上表中的数据判断工业合成氨的反应是放热(填“吸热”或“放热”)反应.
(2)在298K时,取1mol N2和3mol H2放入一密闭容器中,在催化剂存在下进行反应.理论上放出或吸收的热量为Q1,则Q1为93kJ.
(3)实际生产中,放出或吸收的热量为Q2,Q1与Q2的大小关系是Q1>Q2,理由该反应为可逆反应,在密闭容器中进行反应达到平衡时,1 mol N2和3 mol H2不能完全反应生成2 mol NH3,因而放出热量小于93 kJ.
| 化学键 | H-H | N≡N | N-H |
| 键能(kJ/mol) | 436 | 946 | 391 |
(2)在298K时,取1mol N2和3mol H2放入一密闭容器中,在催化剂存在下进行反应.理论上放出或吸收的热量为Q1,则Q1为93kJ.
(3)实际生产中,放出或吸收的热量为Q2,Q1与Q2的大小关系是Q1>Q2,理由该反应为可逆反应,在密闭容器中进行反应达到平衡时,1 mol N2和3 mol H2不能完全反应生成2 mol NH3,因而放出热量小于93 kJ.
6.一种化学冰袋中含有Na2SO4•10H2O和NH4NO3,将它们混合并用手搓揉就可制冷,且制冷效果能维持一段时间.以下关于其制冷原因的推测,肯定错误的是( )
| A. | Na2SO4•10H2O脱水是吸热过程 | |
| B. | 较长时间制冷是由于Na2SO4•10H2O脱水是较慢的过程 | |
| C. | 铵盐在该条件下,发生的复分解反应是吸热反应 | |
| D. | NH4NO3溶于水会吸收热量 |
3. 某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g)△H<0,如图表示该反应的速率随时间变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是( )
某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g)△H<0,如图表示该反应的速率随时间变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是( )
 某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g)△H<0,如图表示该反应的速率随时间变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是( )
某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g)△H<0,如图表示该反应的速率随时间变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是( )| A. | t2时升高了温度 | |
| B. | t3时降低了温度 | |
| C. | t5时增大了压强(缩小容器体积) | |
| D. | 平衡状态时,t6时刻Z的百分含量最低 |
4.常温下,下列各组微粒在指定的溶液中一定能大量共存的是( )
| A. | c(OH-)=10-13mol•L-1的溶液中:Na+、NH4+、Cl-、NO3- | |
| B. | 1.0 mol•L-1KI溶液中:Mg2+、Fe2+、SO42-、ClO- | |
| C. | c(Fe3+)=0.1 mol•L-1的溶液中:Na+、NH4+、HCO3-、I- | |
| D. | 饱和氨水中:NH4+、Ag+、SO42-、NO3- |

 探究SO2的性质.甲组同学将SO2分别通入下列3种溶液中.
探究SO2的性质.甲组同学将SO2分别通入下列3种溶液中.