题目内容
3.用FeSO4还原MnO4-,若还原5×10-3mol MnO4-,消耗10mL 2.5mol•L-1FeSO4溶液,则Mn元素在还原产物中的化合价是( )| A. | +1 | B. | +2 | C. | +4 | D. | +5 |
分析 n(Fe2+)=0.01L×2.5mol/L=0.025mol,n(MnO4-)=5×10-3mol,结合氧化还原反应中氧化剂和还原剂得失电子数目相等,表现为化合价升降总数相等,以此解答.
解答 解:n(Fe2+)=0.01L×2.5mol/L=0.025mol,Fe2+被氧化生成Fe3+,失去电子0.025mol,n(MnO4-)=5×10-3 mol,应得到0.025mol电子,设Mn还原后的化合价为x,
则5×10-3 mol×(7-x)=0.025mol,
x=2,
故选B.
点评 本题考查氧化还原反应的计算,侧重于学生计算能力的考查,难度不大,注意根据氧化还原反应中氧化剂和还原剂之间得失电子数目相等的角度解答该类题目.

练习册系列答案
相关题目
13.下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
| A. | 在0.1 mol•L-1NaHCO3溶液中:c(Na+)>c(OH-)>c(HCO3-)>c(H+)>c(CO32-) | |
| B. | 在0.1 mol•L-1Na2CO3溶液中:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) | |
| C. | 一定量(NH4)2SO4与NH3•H2O混合所得的酸性溶液中:c(NH4+)<2c(SO42-) | |
| D. | 向0.4 mol/L CH3COOK溶液中加入等体积1.2 mol/L HCl溶液:c(CH3COO-)+c(CH3COOH)=0.4 mol/L |
14.利用如图所示装置模拟电解原理在工业生产上的应用,下列说法正确的是( )
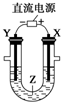

| A. | 氯碱工业中,X电极上反应式是4OH--4e-═2H2O+O2↑ | |
| B. | 电解精炼铜时,Z溶液中的Cu2+浓度不变 | |
| C. | 在铁片上镀铜时,Y是纯铜 | |
| D. | 制取金属镁时,Z是熔融的氯化镁 |
18.下列离子方程式正确的是( )
| A. | 氯气与水反应:Cl2+H2O═Cl-+ClO-+2H+ | |
| B. | 铁与盐酸反应:2Fe+6H+═3H2↑+2Fe3+ | |
| C. | 硫酸与氢氧化钡混合:2H++SO42-+Ba2++2OH?═Ba SO4↓+2 H2O | |
| D. | 向AlCl3溶液中滴入过量NaOH溶液:Al3++3OH-=Al(OH)3↓ |
15.下列溶液或浊液中,关于离子浓度的说法正确的是( )
| A. | 一定浓度的氨水加水稀释的过程中,c(NH4+)/c(NH3•H2O)的比值减小 | |
| B. | 浓度均为0.1 mol•L-1的Na2CO3、NaHCO3混合溶液中:c(CO32-)<c(HCO3-),且3c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)] | |
| C. | 0.2 mol•L-1的醋酸(CH3COOH)溶液与0.1 mol•L-1NaOH溶液等体积混合后:c(CH3COO-)+2 c(OH-)=c(CH3COOH)+2c(H+) | |
| D. | 常温下,已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2Cr2O4)=2.0×10-12,则Ag2CrO4悬浊液中的c(Ag+)一定小于AgCl悬浊液中的c(Ag+) |
12.下列说法正确的是( )
| A. | 甲烷的标准燃烧热为-890.3 kJ•mol-1,则甲烷燃烧的热化学方程式表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 Mpa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件的△H相同 | |
| D. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol |
13.下列各组物质,按化合物、单质、混合物顺序排列的是( )
| A. | 生石灰、氯水、漂白粉 | B. | 烧碱、液氯、食盐水 | ||
| C. | 干冰、食醋、空气 | D. | 盐酸、氮气、胆矾 |
 图为某市售浓盐酸试剂瓶标签上的部分数据.
图为某市售浓盐酸试剂瓶标签上的部分数据.