题目内容
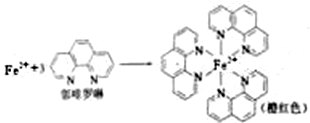 已知:
已知:(1)测定土壤中铁的含量时需先将三价铁还原为二价铁,再采用邻啡罗啉作显色剂,用比色法测定,若土壤中含有高氯酸盐时会对测定有干扰.相关的反应如下:
4FeCl3+2NH2OH?HCl═4FeCl2+N2O↑+6HCl+H2O
①Fe2+在基态时,价层电子排布式
②羟胺(NH2OH)中N原子的杂化方式
③Fe2+与邻啡罗啉形成的配合物中,配位数为
(2)硫酸铜晶体的化学式也可以表达为Cu(H2O)4SO4?H2O晶体,该晶体中含有的化学键类型是
(3)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硫化镉、磷化镓及铜锢硒薄膜电池等.其中元素P、As、Se第一电离能由小到大的顺序为:
(4)①有机太阳能固体电池材料含有高纯度C60,其结构如图1,则1mol C60分子中π键的数目为
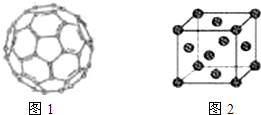
②如果把晶胞顶点与最近三个面心所围成的空隙叫做四面体空隙,第四周期电负性最小的原子可作为容体掺入C60晶体的空隙中,形成具有良好的超导性的掺杂C60化合物.若每个四面体空隙填入一个原子,则全部填满C60晶体的四面体空隙后,所形成的掺杂C60化合物的化学式为
考点:原子核外电子排布,配合物的成键情况,晶胞的计算,原子轨道杂化方式及杂化类型判断
专题:化学键与晶体结构
分析:(1)①铁原子失去最外层4s能级2个电子形成Fe2+,再根据核外电子排布规律进行书写;
②根据价层电子对互斥理论确定羟胺NH2OH中N原子的杂化方式;
③配位数就是在配位个体中与一个形成体成键的配位原子的总数;
(2)阴阳离子存在离子键,非金属元素间易形成共价键,配合物中存在配位键;
(3)同一周期,从左到右,元素的第一电离呈增大趋势,但第VA族元素第一电离能大于第VIA元素;
同一主族,从上到下,元素的第一电离逐渐减小;
(4)①利用均摊法计算每个碳原子含有几个σ键,从而计算1mol C60分子中π键的数目;C60采用面心立方最密堆积;
②晶胞中C60分子间的最短距离为d cm,则棱长为2d×
cm=
cm,晶胞的体积=22
d3cm3,该晶胞中C60分子个数=8×
+6×
=4,再结合ρV=m计算;
(4)三个球相切,摆成正三角形,然后上面放第四个球,这样围成的空隙,就叫正四面体空隙,如图所示: 在面心立方结构中,每个小立方体对应1个四面体空隙,一共有8个正四面体空隙,上图画出了其中一个,第四周期电负性最小的原子是K,所以晶胞中一共有8个k原子,1+6×
在面心立方结构中,每个小立方体对应1个四面体空隙,一共有8个正四面体空隙,上图画出了其中一个,第四周期电负性最小的原子是K,所以晶胞中一共有8个k原子,1+6×
=4个C60分子,然后求出化学式.
②根据价层电子对互斥理论确定羟胺NH2OH中N原子的杂化方式;
③配位数就是在配位个体中与一个形成体成键的配位原子的总数;
(2)阴阳离子存在离子键,非金属元素间易形成共价键,配合物中存在配位键;
(3)同一周期,从左到右,元素的第一电离呈增大趋势,但第VA族元素第一电离能大于第VIA元素;
同一主族,从上到下,元素的第一电离逐渐减小;
(4)①利用均摊法计算每个碳原子含有几个σ键,从而计算1mol C60分子中π键的数目;C60采用面心立方最密堆积;
②晶胞中C60分子间的最短距离为d cm,则棱长为2d×
| ||
| 2 |
| 2 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
(4)三个球相切,摆成正三角形,然后上面放第四个球,这样围成的空隙,就叫正四面体空隙,如图所示:
 在面心立方结构中,每个小立方体对应1个四面体空隙,一共有8个正四面体空隙,上图画出了其中一个,第四周期电负性最小的原子是K,所以晶胞中一共有8个k原子,1+6×
在面心立方结构中,每个小立方体对应1个四面体空隙,一共有8个正四面体空隙,上图画出了其中一个,第四周期电负性最小的原子是K,所以晶胞中一共有8个k原子,1+6×| 1 |
| 2 |
解答:
解:(1)①铁原子失去最外层4s能级2个电子形成Fe2+,其核外电子排布式为1s22s22p63s23p63d6,价层电子排布式为3d6;
故答案为:3d6;
②羟胺(NH2OH)中氮原子含有3个σ键和1个孤电子对,所以其价层电子对个数是4,该分子属于三角锥形结构,采用sp3杂化;
故答案为:sp3;
③配位数就是在配位个体中与一个形成体成键的配位原子的总数,所以Fe2+与邻啡罗啉形成的配合物(形成过程如图1)中,配位数为6;
故答案为:6;
(2)Cu(H2O)4SO4?H2O中硫酸根离子和Cu(H2O)42+存在离子键,O原子和铜原子之间存在配位键,H2O中H和O之间存在共价键,所以Cu(H2O)4SO4?H2O中所含的化学键有共价键、离子键、配位键;
故答案为:共价键、离子键、配位键;
(3)As和Se属于同一周期,且As属于第VA族,Se属于第VIA族,所以第一电离能As>Se,同一主族,从上到下,元素的第一电离逐渐减小,所以第一电离能As<P,则第一电离能:Se<As<P;
故答案为:Se<As<P;
(4)①每个碳原子含有的π键个数为
,所以1molC60分子中π键的数目为
×60×NA=30NA;C60采用面心立方最密堆积,其配位数为12;
故答案为:30NA;12;
②晶胞中C60分子间的最短距离为d cm,则棱长为2d×
cm=
cm,晶胞的体积=22
d3cm3,该晶胞中C60分子个数=8×
+6×
=4,ρ=
=
,解得d3=720
,则d=
;
故答案为:
;
(5)三个球相切,摆成正三角形,然后上面放第四个球,这样围成的空隙,就叫正四面体空隙,如图所示: 在面心立方结构中,每个小立方体对应1个四面体空隙,一共有8个正四面体空隙,上图画出了其中一个,第四周期电负性最小的原子是K,所以晶胞中一共有8个K原子,1+6×
在面心立方结构中,每个小立方体对应1个四面体空隙,一共有8个正四面体空隙,上图画出了其中一个,第四周期电负性最小的原子是K,所以晶胞中一共有8个K原子,1+6×
=4个C60分子,故组成 K8(C60)4,化学式为K2C60;
故答案为:K2C60.
故答案为:3d6;
②羟胺(NH2OH)中氮原子含有3个σ键和1个孤电子对,所以其价层电子对个数是4,该分子属于三角锥形结构,采用sp3杂化;
故答案为:sp3;
③配位数就是在配位个体中与一个形成体成键的配位原子的总数,所以Fe2+与邻啡罗啉形成的配合物(形成过程如图1)中,配位数为6;
故答案为:6;
(2)Cu(H2O)4SO4?H2O中硫酸根离子和Cu(H2O)42+存在离子键,O原子和铜原子之间存在配位键,H2O中H和O之间存在共价键,所以Cu(H2O)4SO4?H2O中所含的化学键有共价键、离子键、配位键;
故答案为:共价键、离子键、配位键;
(3)As和Se属于同一周期,且As属于第VA族,Se属于第VIA族,所以第一电离能As>Se,同一主族,从上到下,元素的第一电离逐渐减小,所以第一电离能As<P,则第一电离能:Se<As<P;
故答案为:Se<As<P;
(4)①每个碳原子含有的π键个数为
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:30NA;12;
②晶胞中C60分子间的最短距离为d cm,则棱长为2d×
| ||
| 2 |
| 2 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| m |
| V |
| 4×720 | ||
2
|
| 2 |
| 3 | 720
| ||
故答案为:
| 3 | 720
| ||
(5)三个球相切,摆成正三角形,然后上面放第四个球,这样围成的空隙,就叫正四面体空隙,如图所示:
 在面心立方结构中,每个小立方体对应1个四面体空隙,一共有8个正四面体空隙,上图画出了其中一个,第四周期电负性最小的原子是K,所以晶胞中一共有8个K原子,1+6×
在面心立方结构中,每个小立方体对应1个四面体空隙,一共有8个正四面体空隙,上图画出了其中一个,第四周期电负性最小的原子是K,所以晶胞中一共有8个K原子,1+6×| 1 |
| 2 |
故答案为:K2C60.
点评:本题目综合性较大,涉及晶体、化学键、杂化轨道、第一电离、晶胞计算等,晶胞计算难度较大,为易错点.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
钬
Ho的一种同位素可用于制作医疗激光器,其原子核内中子数与核外电子数之差是( )
165 67 |
| A、31 | B、67 | C、98 | D、165 |
下列各组物质中,含原子数最多的是( )
| A、标准状况下5.6L氢气 |
| B、4℃时9mL水 |
| C、11g CO2 |
| D、6.02×1022个H2SO4 |
 某实验小组为了探究镁条与盐酸、醋酸反应时,浓度或温度对反应速率(观察镁条消失的时间)的影响,他们准备了以下化学用品:0.20mol/L与0.40mol/L的HCl溶液、0.2mol/L与0.40mol/L的CH3COOH溶液、4条镁条(形状、大小、质量相同)、几支试管和胶头滴管,酸液温度控制为298K和308K.
某实验小组为了探究镁条与盐酸、醋酸反应时,浓度或温度对反应速率(观察镁条消失的时间)的影响,他们准备了以下化学用品:0.20mol/L与0.40mol/L的HCl溶液、0.2mol/L与0.40mol/L的CH3COOH溶液、4条镁条(形状、大小、质量相同)、几支试管和胶头滴管,酸液温度控制为298K和308K. 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.