题目内容
19. 铁及其化合物在生产生活及科学研究方面应用非常广泛.
铁及其化合物在生产生活及科学研究方面应用非常广泛.(1)Fe2+基态核外电子排布式为1s22s22p63s23p63d6 或[Ar]3d6 ;
(2)Fe3+可与SCN-(阴离子)发生特征的显色反应,用于鉴定Fe3+.
该阴离子的电子式为
 ,其空间构型为直线型;
,其空间构型为直线型;(3)已知Fe2+和Fe3+均可与CN-形成配离子4-和3-,在酸性溶液中H2O2可使Fe(CN)64-转化为Fe(CN)63-.写出以上转化的离子方程式2Fe(CN)64-+H2O2+2H+=2Fe(CN)63-+2H2O;
(4)CN-的其中一个等电子体可与Fe(O)形成配合物,该配合物的化学式为Fe(CO)5,1mol该配合物所含有σ键和π键数目之比为1:1;
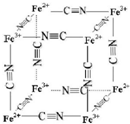
(5)向Fe2+溶液中加入K3,可生成蓝色难溶化合物滕氏蓝,若向Fe3+溶液中加入K4,则可生成蓝色难溶化合物普鲁士蓝,经结构分析,滕氏蓝和普鲁士蓝为同一化合物,其晶胞结构($\frac{1}{8}$)如图所示(K+未标出).
根据上述信息,滕氏蓝和普鲁士蓝晶胞含有4 个Fe2+,其化学式为KFe[Fe(CN)6],含有的化学键有abc(填字母序号).
a.共价键 b.离子键 c.配位键 d.金属键 e.氢键.
分析 (1)铁是26号元素,其原子核外有26个电子,铁原子失去2个电子变成Fe2+,根据构造原理书写Fe2+核外电子排布式;
(2)铁离子和KSCN反应生成络合物为血红色溶液,可用于鉴定Fe3+,SCN-中各原子的连接顺序为S-C-N,S与C形成一对共用电子对,C与N形成三对共用电子对,根据价层电子对互斥理论判断分子空间构型;
(3)在酸性溶液中H2O2可使Fe(CN)64-转化为Fe(CN)63-,根据化合价变化配平该反应的离子方程式;
(4)原子个数相等、价电子数相等的微粒是等电子体;三键中含有1个σ键、2个π键,单键属于σ键;
(5)利用均摊法计算立方体结构中Fe3+、Fe2+、CN-数目,结合电荷守恒计算K+数目,进而确定其化学式;KFe[Fe(CN)6]中含有共价键、离子键、配位键.
解答 解:(1)铁是26号元素,其原子核外有26个电子,铁原子失去最外层2个电子变成Fe2+,根据构造原理知,其基态离子核外电子排布式为1s22s22p63s23p63d6 或[Ar]3d6 ,
故答案为:1s22s22p63s23p63d6 或[Ar]3d6 ;
(2)铁离子和KSCN反应生成络合物,溶液为血红色,发生Fe3++3SCN-=Fe(SCN)3,可用于鉴定Fe3+,SCN-中各原子的连接顺序为S-C-N,S与C形成一对共用电子对,C与N形成三对共用电子对,SCN-得到的一个电子给了S,故SCN-的电子式 ,其中心原子碳原子的价电子对数为$\frac{4+0}{2}$=2,无孤对电子,所以分子空间构型为直线型,
,其中心原子碳原子的价电子对数为$\frac{4+0}{2}$=2,无孤对电子,所以分子空间构型为直线型,
故答案为:SCN-; ;直线型;
;直线型;
(3)在酸性溶液中H2O2可使Fe(CN)64-转化为Fe(CN)63-,双氧水中氧元素化合价为-1价,反应后生成了-2价的水,化合价降低了2价,Fe(CN)64-转化为Fe(CN)63-,铁元素有+2价变为+3价,化合价升高了1价,则化合价变化的最小公倍数为2,所以双氧水的计量数为1,Fe(CN)64-的计量数为2,然后利用质量守恒配平,反应的离子方程式为:2Fe(CN)64-+H2O2+2H+=2Fe(CN)63-+2H2O,
故答案为:2Fe(CN)64-+H2O2+2H+=2Fe(CN)63-+2H2O;
(4)原子个数相等、价电子数相等的微粒是等电子体,氢氰根离子中含有2个原子、价电子数是10,与CN-互为等电子体的一种分子为CO,可与Fe(0)形成配合物,为Fe(CO)5,CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,则CO的结构式为C≡O,三键中含有1个σ键、2个π键,单键属于σ键,则CO分子中σ键和π键数目比为1:2,1molFe(CO)5所含有σ键和π键数目之比为2:2=1:1,
故答案为:Fe(CO)5;1:1;
(5)立方体结构中Fe3+离子的个数为:4×$\frac{1}{8}$=$\frac{1}{2}$,Fe2+离子的个数为:4×$\frac{1}{8}$=$\frac{1}{2}$,CN-离子的个数为:12×$\frac{1}{4}$=3,
根据电荷守恒:N(K+)+N(Fe3+)×3+N(Fe2+)×2=N(CN-),得N(K+)=$\frac{1}{2}$,
普鲁士蓝中 n(K+):n(Fe3+):n(Fe2+):n(CN-)=1:1:1:6,则其化学式为KFe[Fe(CN)6];Fe3+含有空轨道,CN-中N原子提供孤电子对,形成配位键,亚铁离子、钾离子和[Fe(CN)6]3- 形成离子键,碳原子和氮原子之间存在共价键,所以abc符合,
故答案为:4;KFe[Fe(CN)6];abc.
点评 本题考查了物质结构和性质,涉及核外电子排布式书写、等电子体、配合物、晶胞的计算等知识点,掌握均摊法进行晶胞计算,题目难度中等.

| A. | 副族元素没有非金属元素 | |
| B. | 除短周期外,其他周期均为18种元素 | |
| C. | 同周期相邻的第ⅡA族和第ⅢA族的元素,原子序数只相差1 | |
| D. | 核外电子排布相同的微粒化学性质也相同 |
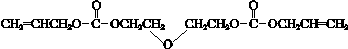
已知:i.CR-39单体结构简式是:
ii.酯与醇有如下反应:
RCOOR′+R″OH$→_{△}^{催化剂}$RCOOR″+R′OH(R、R′、R″代表烃基)
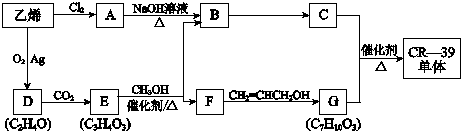
(1)乙烯转化为A的反应类型是加成反应.
(2)在D、E的分子中,都只有一种化学环境的氢原子.
①D的结构简式是
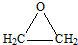 .
.②E为五元环状化合物,E与CH3OH反应的化学方程式是
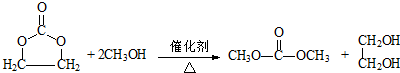 .
.(3)G与足量NaOH溶液反应的化学方程式是
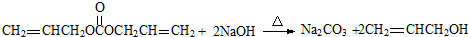 .
.(4)F的一种同分异构体K,其分子中不同化学环境的氢原子个数比是3:1:1:1,且能与NaHCO3反应.
①K能发生消去反应,生成的有机物的结构简式是
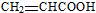 .
.②K在一定条件下合成高分子化合物的化学方程式是
 .
.(5)下列有关C的叙述正确的是(填写序号)acd.
| a.能与乙酸发生酯化反应 | b.能与乙醇发生酯化反应 |
| c.1mol C最多能与2mol Na反应 | d.C的同分异构体不能发生银镜反应 |
| A. | 1 mol 氢氧根和1 mol 羟基中含有的质子数均为 9 NA | |
| B. | 1mol Cl2参加反应,转移电子数一定为2NA | |
| C. | 标准状况下,2.24 L氯仿(CHCl3)中含有C-Cl数目为0.3NA | |
| D. | 0.5 mol O3与11.2 LO2所含的分子数一定相等 |
| A. |  的名称:2-甲基乙醇 的名称:2-甲基乙醇 | B. | 聚丙烯的链节: | ||
| C. | 甲酸甲酯的结构简式:C2H4O2 | D. | 比例模型为 的分子可发生加成反应 的分子可发生加成反应 |
| 选项 | 实 验 操 作 | 实验目的或结论 |
| A | 向某溶液中加入几滴氯水后再滴入KSCN溶液,溶液变红 | 该溶液中一定含Fe2+ |
| B | 将吸有NaOH溶液的长胶头滴管伸入盛有FeSO4溶液的试管底部并缓慢挤出碱液 | 防止加碱过程中带入空气,制备并较长时间观察到白色絮状的Fe(OH)2沉淀 |
| C | 蒸馏实验操作时将温度计插入液面以下但不能触碰到烧瓶内壁 | 准确测定馏分的温度,以便于液体混合物分离 |
| D | Fe(OH)3胶体的电泳实验中发现阴极附近颜色加深而阳极附近颜色变浅 | 说明Fe(OH)3胶体带正电荷 |
| A. | A | B. | B | C. | C | D. | D |
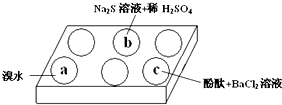
 HSO3-+OH-,所以滴入酚酞后溶液变红,在该溶液中加入BaCl2后,Ba2++SO32-=BaSO3↓(白色),由于c(SO32-)减小,SO32-水解平衡左移,c(OH-)减小,红色褪去.
HSO3-+OH-,所以滴入酚酞后溶液变红,在该溶液中加入BaCl2后,Ba2++SO32-=BaSO3↓(白色),由于c(SO32-)减小,SO32-水解平衡左移,c(OH-)减小,红色褪去.