题目内容
焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈.发生的反应体系中共有六种物质:NH4C1、FeC13、N2、Fe2O3、Fe和X.
(1)写全该反应的化学方程式,并用双线桥法标出该反应的电子转移情况:6NH4C1+4Fe2O3═3N2+6Fe+2FeC13+ ;
(2)当转移的电子总数为a个时,氮气物质的量变化了bmol,阿伏加德罗数常数为(用含a、b的代数式表示) .
(3)反应中被氧化产生了11.2L(标准状况)的气体时,被还原的物质的物质的量为 mol.
(1)写全该反应的化学方程式,并用双线桥法标出该反应的电子转移情况:6NH4C1+4Fe2O3═3N2+6Fe+2FeC13+
(2)当转移的电子总数为a个时,氮气物质的量变化了bmol,阿伏加德罗数常数为(用含a、b的代数式表示)
(3)反应中被氧化产生了11.2L(标准状况)的气体时,被还原的物质的物质的量为
考点:氧化还原反应的计算,化学方程式的有关计算,氧化还原反应
专题:计算题
分析:由焊药为氯化铵,其作用是消除焊接处的铁锈可知反应物为NH4Cl、Fe2O3,则该反应得生成物为FeCl3、N2、Fe和X,根据元素守恒可知X中含有H、O元素,则X为H2O,
(1)由原子守恒配平反应,反应中N失去电子,Fe得到电子,转移18mol电子;
(2)生成3mol氮气转移18NA个电子,以此计算;
(3)11.2L(标准状况)的气体,其物质的量为
=0.5mol,由6NH4Cl+4Fe2O3═6Fe+2FeCl3+3N2↑+12H2O可知,气体与起氧化剂作用的氧化铁得关系为3N2~3Fe2O3,以此计算.
(1)由原子守恒配平反应,反应中N失去电子,Fe得到电子,转移18mol电子;
(2)生成3mol氮气转移18NA个电子,以此计算;
(3)11.2L(标准状况)的气体,其物质的量为
| 11.2L |
| 22.4L/mol |
解答:
解:由焊药为氯化铵,其作用是消除焊接处的铁锈可知反应物为NH4Cl、Fe2O3,则该反应得生成物为FeCl3、N2、Fe和X,根据元素守恒可知X中含有H、O元素,则X为H2O,
(1)由原子守恒可知反应为6NH4Cl+4Fe2O3═6Fe+2FeCl3+3N2↑+12H2O,反应中N失去电子,Fe得到电子,转移18mol电子,双线桥法标出该反应的电子转移情况为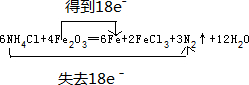 ,故答案为:12H2O;
,故答案为:12H2O;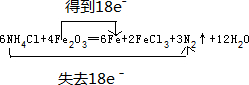 ;
;
(2)生成3mol氮气转移18NA个电子,转移的电子总数为a个时,氮气物质的量变化了bmol,则
=
,解得NA=
,故答案为:
;
(3)11.2L(标准状况)的气体,其物质的量为
=0.5mol,由6NH4Cl+4Fe2O3═6Fe+2FeCl3+3N2↑+12H2O可知,气体与起氧化剂作用的氧化铁得关系为3N2~3Fe2O3,则被还原的物质的质量为0.5mol,故答案为:0.5.
(1)由原子守恒可知反应为6NH4Cl+4Fe2O3═6Fe+2FeCl3+3N2↑+12H2O,反应中N失去电子,Fe得到电子,转移18mol电子,双线桥法标出该反应的电子转移情况为
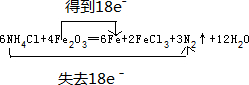 ,故答案为:12H2O;
,故答案为:12H2O;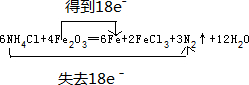 ;
;(2)生成3mol氮气转移18NA个电子,转移的电子总数为a个时,氮气物质的量变化了bmol,则
| 18NA |
| 3 |
| a |
| b |
| a |
| 6b |
| a |
| 6b |
(3)11.2L(标准状况)的气体,其物质的量为
| 11.2L |
| 22.4L/mol |
点评:本题考查氧化还原反应得配平及有关计算,为高频考点,根据电子守恒及质量守恒定律得出化学反应方程式是解答本题的关键,并注意(3)利用关系式或电子守恒计算,题目难度中等.

练习册系列答案
相关题目
N2O5是一种新型绿色硝化剂,其性质和制备受到人们的关注.已知一定条件下会发生反应:2N2O5(g)?4NO2(g)+O2(g)△H>0,平衡常数为K.下列叙述正确的是( )
| A、上述反应的平衡常数随温度升高而增大 |
| B、上述反应达到平衡后,只增大氧气浓度,因为K值变大了,所以平衡将向左移动 |
C、N2O5与苯发生硝化反应除了生成硝基苯(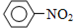 ),还有氧气生成 ),还有氧气生成 |
| D、以N2O4等为原料采用电化学方法可以合成N2O5,该合成应避免碱性环境 |
若需通过导电实验证明NaCl是离子化合物,可以选择的实验对象是( )
| A、NaCl固体 |
| B、NaCl水溶液 |
| C、NaCl熔融液 |
| D、以上都不可以 |
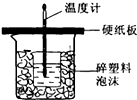 I.已知中和热是指酸跟碱发生中和反应生成lmol H2O时的反应热.
I.已知中和热是指酸跟碱发生中和反应生成lmol H2O时的反应热.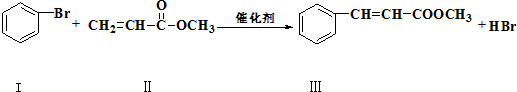

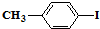 和
和 也可以发生类似如图的反应,有机产物的结构简式
也可以发生类似如图的反应,有机产物的结构简式