题目内容
在一可压缩的密闭容器中,发生可逆反应:M(g)+N(?)P(g)+Q(g)△H>0,当压缩体积时,M的转化率不变.在其它条件不变的情况下,采用以下措施使M的转化率增大( )
| A、加入一定量的M |
| B、加入一定量的不与M、N、P、Q反应的气体 |
| C、反应温度升高 |
| D、加入某物质作催化剂 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:可逆反应:M(g)+N(?)?P(g)+Q(g)△H>0,当压缩体积时,M的转化率不变,说明平衡不移动,即反应两边的气体体积相等,故N为气体,若使M的转化率增大,可在不加M的情况下使平衡右移即可.
解答:
解:可逆反应:M(g)+N(?)?P(g)+Q(g)△H>0,当压缩体积时,M的转化率不变,说明平衡不移动,即反应两边的气体体积相等,故N为气体,
A、加入一定量的M,M的转化率减小,故A错误;
B、加入一定量的不与M、N、P、Q反应的气体,不影响化学平衡,故B错误;
C、反应温度升高,平衡向吸热方向移动,平衡右移,M的转化率增大,故C正确;
D、加入催化剂,不影响化学平衡,故D错误.
故选:C.
A、加入一定量的M,M的转化率减小,故A错误;
B、加入一定量的不与M、N、P、Q反应的气体,不影响化学平衡,故B错误;
C、反应温度升高,平衡向吸热方向移动,平衡右移,M的转化率增大,故C正确;
D、加入催化剂,不影响化学平衡,故D错误.
故选:C.
点评:本题考查化学平衡的移动原理的分析应用,反应特征和影响因素的分析判断是解题关键,题目难度中等.

练习册系列答案
相关题目
BF3是典型的平面三角形分子,它溶于氢氟酸或NaF溶液中都形成BF4-离子,则BF3和BF4-中的B原子的杂化轨道类型分别是( )
| A、sp2、sp2 |
| B、sp3、sp3 |
| C、sp2、sp3 |
| D、sp、sp2 |
在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)?2Z(g)△H<0,一段时间后达到平衡.反应过程中测定的数据如下表:下列说法不正确的是( )
| T/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A、反应前2 min的平均速率v(Z)=2.0×10-3mol/(L?min) |
| B、其他条件不变,升高温度,反应达到新平衡前v(逆)>v (正) |
| C、该温度下此反应的平衡常数K=1.44 |
| D、其他条件不变,再充入0.2 mol Z,平衡时X的体积分数不变 |
下列说法正确的是( )
| A、△H>0、△S>0的反应一定不能自发进行 |
| B、反应4Al(s)+3O2(g)=2Al2O3 (s)的△H<0、△S>0 |
| C、反应物分子有效碰撞次数增加则反应物的浓度一定增加 |
| D、压强和浓度对反应速率的影响都是通过改变单位体积活化分子数从而影响有效碰撞次数实现的 |
下列关于胶体与溶液的说法正确的是( )
| A、胶体与溶液的本质区别在于能否发生丁达尔效应 |
| B、利用滤纸可以分离胶体与溶液 |
| C、向沸水中滴加饱和氯化铁溶液可制得氢氧化铁胶体 |
| D、蔗糖、淀粉、蛋白质的水溶液均能产生丁达尔现象 |
按照阿伏加德罗定律,下列叙述不正确的( )
| A、同温同压下两种气体的体积之比等于物质的量之比 |
| B、同温同压下两种气体的物质的量之比等于密度之比 |
| C、同温同压下两种气体的密度之比等于摩尔质量之比 |
| D、同温同体积下两种气体的物质的量之比等于压强之比 |
下列方程式正确的是( )
A、用铁丝网作电极,电解饱和食盐水:2Cl-+2H2O
| ||
| B、Ba(OH)2溶液中加入过量的Al2(SO4)3溶液:3Ba2++6OH-+2Al3++3SO42-→3BaSO4↓+2Al(OH)3↓ | ||
| C、向H218O中投入Na2O2固体:2H218O+2Na2O2→4Na++4OH-+18O2↑ | ||
| D、石灰乳中Ca(OH)2的电离:Ca(OH)2(s)?Ca2++2OH- |
设NA 为阿伏加德罗常数的值.下列说法正确的是( )
| A、0.1 mol?L-1的NaHCO3 溶液中含有Na+的数目为0.1NA |
| B、标准状况下,1mol苯含有C=C 双键的数目为3NA |
| C、常温常压下,14 g 由N2与CO组成的混合气体含有的原子数目为NA |
| D、标准状况下,22.4L NO2与水充分反应转移的电子数目为0.1NA |

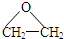 ),而且原子利用率为100%,为绿色化学,写出反应方程式
),而且原子利用率为100%,为绿色化学,写出反应方程式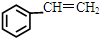 可被氧化剂氧化生成
可被氧化剂氧化生成  、HCOOH和H2O,该氧化剂为:
、HCOOH和H2O,该氧化剂为: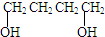 和2mol乙酸在浓硫酸作用下生成分子式为C8H14O4的酯,写出反应方程式:
和2mol乙酸在浓硫酸作用下生成分子式为C8H14O4的酯,写出反应方程式: