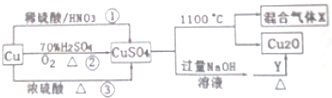
题目内容
15.将铜片投入到稀硫酸中,铜片不溶,加入下列试剂后,可使铜片溶解的是( )| A. | 稀盐酸 | B. | Na2SO4晶体 | C. | KNO3晶体 | D. | FeCl3晶体 |
分析 铜为不活泼金属,与非氧化性酸不反应,加入试剂后铜溶解,说明在酸性条件下所加试剂具有强氧化性,以此解答该题.
解答 解:A、盐酸、稀硫酸都为非氧化性酸,铜片不溶解,故A错误;
B、加入硫酸钠晶体后,溶液中存在的主要离子为:Na+、H+、SO42-,没有强氧化性离子,铜片不溶解,故B错误;
C、加入硝酸钠晶体后,溶液中存在的主要离子为:Na+、H+、NO3-、SO42-,Cu与H+、NO3-、发生氧化还原反应使铜片溶解,故C正确;
D、加入氯化铁晶体后,溶液中存在的主要离子为:H+、SO42-、Cl-、Fe3+,铜片与Fe3+发生氧化还原反应使铜片溶解,故D正确;
故选CD.
点评 本题考查的是铜金属及其化合物、硝酸的化学性质,侧重于元素化合物知识的综合理解和运用的考查,挖掘隐含条件是解决本题的关键,难度不大.

练习册系列答案
相关题目
3.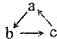 已知abc是中学常见的含有同种元素的三种物质,具有如图的转化关系(“→”表示在一定条件下可一步完成),下列各组物质中,不符合上述转化关系的是( )
已知abc是中学常见的含有同种元素的三种物质,具有如图的转化关系(“→”表示在一定条件下可一步完成),下列各组物质中,不符合上述转化关系的是( )
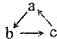 已知abc是中学常见的含有同种元素的三种物质,具有如图的转化关系(“→”表示在一定条件下可一步完成),下列各组物质中,不符合上述转化关系的是( )
已知abc是中学常见的含有同种元素的三种物质,具有如图的转化关系(“→”表示在一定条件下可一步完成),下列各组物质中,不符合上述转化关系的是( )| 选项 对应物质 | A | B | C | D |
| a | Cu(OH)2 | Na2O | Fe | Mg |
| b | CuCl2 | NaCl | FeCl3 | MgO |
| c | Cu | Na | FeCl2 | MgCl2 |
| A. | A | B. | B | C. | C | D. | D |
10.普通铜器时间稍久容易出现铜绿.但我国流传下来的1760年铜铸国宝现在看上去仍然熠熠生辉不生锈,下列对其原因的分析,最可能的是( )
| A. | 它们的表面都电镀上一层耐腐蚀的黄金 | |
| B. | 环境污染日趋严重,它们表面的铜绿被酸雨溶解洗去 | |
| C. | 铜的金属活动性比氢小,因此不易被氧化 | |
| D. | 它们是含一定比例金、银、锡、锌的铜合金 |
20.a为乙二胺四乙酸(EDTA),易与金属离子形成螯合物.b为EDTA与Ca2+形成的螯合物.下列叙述正确的是( )
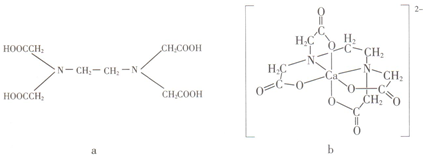

| A. | a和b中的N原子均为sp3杂化 | B. | b中Ca2+的配位数为4 | ||
| C. | b含有分子内氢键 | D. | b含有共价键、离子键和配位键 |
4.下列有关现象或事实的解释正确的是( )
| 现象或事实 | 解释 | |
| A | 进行中和热测定时,将NaOH溶液一次性快速倒入盛有H2SO4的量热计中 | 减少热量散失,减少测量误差 |
| B | 加热滴有酚酞试剂的纯碱溶液,溶液红色变深 | 加热促进水的电离,溶液的碱性增强 |
| C | 电解AlCl3水溶液,阴极周围出现白色胶状沉淀 | 生产的Al(OH)3胶体粒子带正电荷,发生定向移动 |
| D | 用FeCl3溶液制作印刷线路板 | FeCl3能从含有Cu2+的溶液中置换出Cu |
| A. | A | B. | B | C. | C | D. | D |
5.下列变化不能用勒夏特列原理解释的是( )
| A. | 工业生产硫酸的过程中使用过量的空气,以提高二氧化硫的转化率 | |
| B. | 氯化镁溶液加热蒸干最终得不到氯化镁固体 | |
| C. | 实验室用排饱和食盐水的方法手机氯气 | |
| D. | 合成氨是放热反应,采用在较高温度下进行反应 |