题目内容
5.CuSO4是一种重要化工原料,其制备和有关性质如图所示.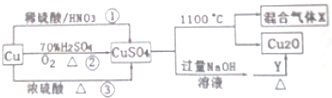
(1)途径①②③,更好体现绿色化学思想的是②
(2)物质Y具有的性质还原性(填“氧化性”或“还原性”)
(3)混合气体X既能是品红溶液褪色又能使带火星木条复燃,则混合气体X的成分是SO2与O2
(4)途径①所用混酸中H2SO3与HNO3物质的量之比是3:2,并写出发生反应的离子方程式3Cu3++8H++2NO3-=3Cu2++2NO↑+4H2O.
分析 (1)途径②中Cu与氧气反应生成CuO,再与硫酸反应生成硫酸铜和水,不生成有毒气体;
(2)由转化可知,生成的氢氧化铜转化为氧化亚铜,Cu元素的化合价降低,则Y中某元素的化合价升高;
(3)硫酸铜分解生成Cu2O,Cu元素的化合价降低,S元素为最高价不能升高,所以O元素的化合价升高;
(4)发生3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,离子反应为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,以此来解答.
解答 解:(1)途径①中Cu与硝酸反应生成有毒的NO气体、③中铜和浓硫酸反应会生成二氧化硫气体污染空气,途径②的优点:制取等质量胆矾需要的硫酸少、途径②无污染性气体产生,更好地体现了绿色化学思想,故答案为:②;
(2)Y可能为葡萄糖或醛,若为葡萄糖,发生C6H12O6+2Cu(OH)2=C6H12O7+Cu2O+2H2O,Cu元素的化合价降低,则Y中某元素的化合价升高,则Y具有还原性,
故答案为:还原性;
(3)硫酸铜分解生成Cu2O,Cu元素的化合价降低,S元素为最高价不能升高,所以O元素的化合价升高,即有氧气生成,发生2CuSO4═Cu2O+SO2↑+SO3↑+O2↑,所得混合气体X中一定有SO2与O2,故答案为:SO2与O2;
(4)Cu与混酸反应,3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,离子反应为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,从方程式知,硝酸根离子由硝酸提供,氢离子由硝酸和硫酸提供,所以硝酸为2mol时,硫酸为3mol,用混酸中H2SO4与HNO3物质的量之比最好为3:2,
故答案为:3:2;3Cu3++8H++2NO3-=3Cu2++2NO↑+4H2O.
点评 本题考查制备实验及物质的性质,为高频考点,把握制备反应原理、物质的性质为解答的关键,侧重分析与实验能力的考查,题目难度不大.

| A. | 0.1 mol/L的NaOH溶液与0.2 mol/L的HCN溶液等体积混合,所得溶液呈碱性:c (Na+)>c (CN-)>c (HCN)>c (OH-)>c (H+) | |
| B. | 20 mL 0.1 mol/L的Na2CO3溶液与等体积等浓度的盐酸混合充分反应后的溶液中:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)=2c(Cl-)=0.1 mol/L | |
| C. | 浓度均为1 mol/L的以下溶液:①醋酸 ②NaOH溶液 ③盐酸 ④醋酸钠溶液,其水的电离程度的关系为:④>①>③>② | |
| D. | 相同温度下,pH值相同的CH3COONa溶液与NaHCO3溶液一定存在关系:c(CH3COO-)=c(HCO3-)+2c(CO32-) |
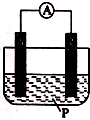 如图所示装置中,可观察到电流表指针偏转;M棒变粗,N棒变细,由此判断下表所列M、N、P物质,其中可以成立的是 ( )
如图所示装置中,可观察到电流表指针偏转;M棒变粗,N棒变细,由此判断下表所列M、N、P物质,其中可以成立的是 ( )| 选项 | M | N | P |
| A | 锌 | 铜 | 稀硫酸溶液 |
| B | 铜 | 锌 | 稀盐酸 |
| C | 银 | 锌 | 硝酸银溶液 |
| D | 锌 | 铁 | 硝酸铁溶液 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 质子数为7、中子数为8的氮原子:${\;}_{7}^{8}$N | |
| B. | 溴化铵的电子式: | |
| C. | 氮原子的结构示意图: | |
| D. | 间硝基甲苯的结构简式: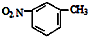 |
| A. | 电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-═Cl2↑ | |
| B. | 氢氧燃料电池的负极反应式:O2+4H++4e-═2H2O | |
| C. | 粗铜精炼时,与电源正极相连是纯铜,电极反应式为Cu-2e-═Cu2+ | |
| D. | 钢铁发生电化学腐蚀的正极反应式:Fe-2e-═Fe2+ |
| A. | 服用铬含量超标的药用胶囊会对人对健康造成危害 | |
| B. | 食用一定量的油脂能促进人体对某些维生素的吸收 | |
| C. | “血液透析”利用了胶体的性质 | |
| D. | 使用填埋法处理未经分类的生活垃圾 |
| A. | 稀盐酸 | B. | Na2SO4晶体 | C. | KNO3晶体 | D. | FeCl3晶体 |
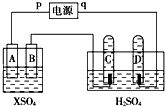 如图,p、q为直流电源的两极,A由+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D极上均产生气泡,试回答:
如图,p、q为直流电源的两极,A由+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D极上均产生气泡,试回答: