题目内容
10.普通铜器时间稍久容易出现铜绿.但我国流传下来的1760年铜铸国宝现在看上去仍然熠熠生辉不生锈,下列对其原因的分析,最可能的是( )| A. | 它们的表面都电镀上一层耐腐蚀的黄金 | |
| B. | 环境污染日趋严重,它们表面的铜绿被酸雨溶解洗去 | |
| C. | 铜的金属活动性比氢小,因此不易被氧化 | |
| D. | 它们是含一定比例金、银、锡、锌的铜合金 |
分析 中国圆明园流失文物鼠首和兔首铜像属于铜合金,合金是指在一种金属中加热熔合其它金属或非金属而形成的具有金属特性的物质,合金的性质是:硬度大、熔点低、耐腐蚀等,根据金属活动性顺序和金属单质与盐溶液能否发生置换反应进行判断,铜在金属活动性顺序中排在氢的后面,不能置换出酸中的氢,所以铜合金文物不容易被酸雨腐蚀,电化学腐蚀,正极被保护,以此解答该题.
解答 解:A.铜铸的牛首、猴首和虎首不是进行的电镀,而是形成合金.故A错误;
B.牛首、猴首和虎首放在外面不会让酸雨腐蚀.因为铜和稀酸不反应,故B错误;
C.铜在加热的条件下,会与氧气反应生成氧化铜,故C错误;
D.牛首、猴首和虎首是含一定比例金、银、锡、锌的铜合金,形成原电池时铜做正极被保护,耐腐蚀性好,故D正确;
故选D.
点评 本题主要考查合金与合金的性质,关键是合金概念即和性质应用,原电池的原理应用,理解合金的硬度比它中的任何一种金属的硬度都大,熔点比较低,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.化学用语是学习化学的重要工具,下列表示物质变化的化学用语中正确的是( )
| A. | 电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-═Cl2↑ | |
| B. | 氢氧燃料电池的负极反应式:O2+4H++4e-═2H2O | |
| C. | 粗铜精炼时,与电源正极相连是纯铜,电极反应式为Cu-2e-═Cu2+ | |
| D. | 钢铁发生电化学腐蚀的正极反应式:Fe-2e-═Fe2+ |
18.卤素是最活泼的一族非金属,下列关于卤族元素的说法正确的是( )
| A. | 卤素单质的最外层电子数都是7 | |
| B. | 卤素单质与H2化合的容易程度为F2<Cl2<Br2<I2 | |
| C. | 卤素单质与H2化合的产物由上至下稳定性减弱,其水溶液的酸性增强 | |
| D. | 从F到I,元素非金属性依次减弱,则其最高价氧化物的水化物的酸依次减弱 |
5.下列两种物质,不需要加热就能反应生成气体的是( )
| A. | Cu+H2SO4(浓) | B. | Cu+HNO3(浓) | C. | Fe+H2SO4(浓) | D. | C+H2SO4(浓) |
15.将铜片投入到稀硫酸中,铜片不溶,加入下列试剂后,可使铜片溶解的是( )
| A. | 稀盐酸 | B. | Na2SO4晶体 | C. | KNO3晶体 | D. | FeCl3晶体 |
2.在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅.
(1)该反应的化学方程式为N2O4?2NO2,表中b>c(填“<”、“=”或“>”).
(2)0~20s内N2O4的平均反应速率为0.003mol/(L•s).
(3)该反应的平衡常数表达式K=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$,在80℃时该反应的平衡常数K值为0.54(保留2位小数).
| 时间(s) C(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| C(N2O4) | 0.20 | a | 0.10 | c | d | e |
| C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
(1)该反应的化学方程式为N2O4?2NO2,表中b>c(填“<”、“=”或“>”).
(2)0~20s内N2O4的平均反应速率为0.003mol/(L•s).
(3)该反应的平衡常数表达式K=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$,在80℃时该反应的平衡常数K值为0.54(保留2位小数).
19.下列说法正确的是( )
| A. | 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H相同 | |
| B. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| C. | 在加热条件下发生的反应均为吸热反应 | |
| D. | 物质发生化学反应时不一定都伴随着能量变化 |
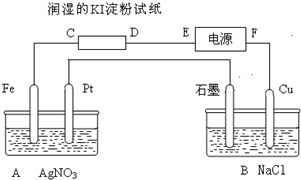 有电解装置如图所示.图中A装置盛1L 2mol/L AgNO3溶液.通电后,润湿的淀粉KI试纸的C端变蓝色,电解一段时间后试回答:
有电解装置如图所示.图中A装置盛1L 2mol/L AgNO3溶液.通电后,润湿的淀粉KI试纸的C端变蓝色,电解一段时间后试回答: