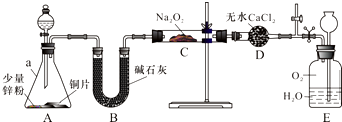
题目内容
13.下列说法正确的是(设NA为阿伏加德罗常数)( )| A. | 在标准状况下,22.4 L苯所含的分子数为NA | |
| B. | 0.1 mol/L NaOH溶液所含的Na+数为0.1NA | |
| C. | 在常温常压下,11.2 L CH4所含的氢原子数为2NA | |
| D. | 在标准状况下,14 g氮气所含的核外电子数为7NA |
分析 A、标况下苯为液态;
B、溶液体积不明确;
C、常温常压下,气体摩尔体积大于22.4L/mol;
D、求出氮气的物质的量,然后根据1mol氮气中含14mol电子来分析.
解答 解:A、标况下苯为液态,故不能根据气体摩尔体积来计算苯的物质的量和分子个数,故A错误;
B、溶液体积不明确,故溶液中的钠离子的个数无法计算,故B错误;
C、常温常压下,气体摩尔体积大于22.4L/mol,故11.2L甲烷的物质的量小于0.5mol,故含有的H原子个数小于2NA个,故C错误;
D、14g氮气的物质的量为0.5mol,而1mol氮气中含14mol电子,故0.5mol氮气中含7NA个电子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
3.118号元素(Og)是2015年底进入周期表的新成员之一,${\;}_{118}^{297}$Og的中子数为( )
| A. | 297 | B. | 179 | C. | 118 | D. | 61 |
8.下列各组物质中,互为同系物的是( )
| A. | $\stackrel{234}{92}$U和$\stackrel{238}{92}$U | B. | CO2和干冰 | C. | CH4和CH3CH2CH3 | D. | 正丁烷和异丁烷 |
18.为探究影响锌与稀硫酸反应速率[以v(H2)表示]的一些因素,其他条件一定,向反应体系中加入某些物质,下列判断正确的是( )
| A. | 加入少量NaHCO3固体,v(H2)不变 | B. | 加入少量Na2SO4固体,v(H2)增大 | ||
| C. | 加入少量NaHSO4固体,v(H2)增大 | D. | 加入少量CuSO4溶液,v(H2)减小 |
5.下列说法不正确的是( )
| A. | (CH3)2C═O+HCN→(CH3)2C(OH)CN 属于加成反应 | |
| B. | CH3OH、CH2OHCH2OH、CH2OHCHOHCH2OH是同系物 | |
| C. |  属于取代反应 属于取代反应 | |
| D. | 1molCH3CH3与Cl2完全反应生成六氯乙烷时,消耗Cl26mol |
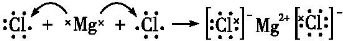 .
.

 .分别写出②和⑦、③和⑧化合产物的电子式
.分别写出②和⑦、③和⑧化合产物的电子式 、
、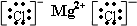 .⑤和⑥的气态氢化物的稳定性NH3>CH4(写化学式).⑦和⑧的最高价氧化物的水化物的酸性HClO4>H2SO4(写化学式).
.⑤和⑥的气态氢化物的稳定性NH3>CH4(写化学式).⑦和⑧的最高价氧化物的水化物的酸性HClO4>H2SO4(写化学式).