题目内容
15.将等质量的两份锌粉a、b分别加入过量的稀硫酸,同时向a中加少量CuSO4溶液,如图中产生H2的体积V (L)与时间t(min)的关系,其中正确的是( )| A. | 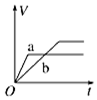 | B. | 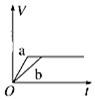 | C. | 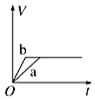 | D. | 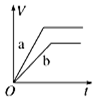 |
分析 锌和硫酸反应,加入硫酸铜,会置换出金属铜,形成锌、铜、稀硫酸原电池,加速金属锌和硫酸反应的速率,产生氢气的量取决于金属锌的质量,以此解答.
解答 解:锌和硫酸反应,加入硫酸铜,会置换出金属铜,形成锌、铜、稀硫酸原电池,加速金属铁和硫酸反应的速率,所以反应速率是:a>b,速率越大,锌完全反应时所用的时间越短,所以a所用的时间小于b的时间;产生氢气的量取决于金属锌的质量,而a中,金属锌一部分用于置换金属铜,导致和硫酸反应生成氢气的量减少,所以氢气的体积是:a<b.
故选A.
点评 本题考查化学反应速率的影响因素,为高考高频考点,侧重于学生的分析能力的考查,注意原电池反应的特点以及稀硫酸过量的信息,难度不大.

练习册系列答案
相关题目
14.化学在生产和生活中有着重要的作用.下列有关说法正确的是( )
| A. | 黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质 | |
| B. | 安装煤炭燃烧过程的“固硫”装置,主要是为了提高煤的利用率 | |
| C. | 施用适量石灰乳可降低盐碱地(含较多NaCl、Na2CO3)的碱性 | |
| D. | 用含有橙色的酸性重铬酸钾的仪器检验酒后驾车,利用了乙醇的氧化性 |
6.Na2FeO4可通过电解法制备,装置如图,下列说法正确的是( )


| A. | Pt周围的pH降低 | |
| B. | 当生成标准状况下22.4LH2时,转移的电子数为1.5 NA | |
| C. | 阳极反应式是Fe-6e-+8OH-═FeO42-+4H2O | |
| D. | 制得1mol Na2FeO4,有8molOH-从左向右通过离子交换膜 |
3.合成导电高分子化合物PPV的反应为:
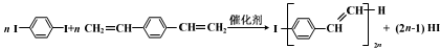
下列说法正确的是( )
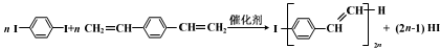
下列说法正确的是( )
| A. | PPV 是聚苯乙烯 | |
| B. | PPV 难溶于水,易溶于乙醇等有机溶剂 | |
| C. |  属于芳香烃 属于芳香烃 | |
| D. | 1mo  最多可与5molH2发生反应 最多可与5molH2发生反应 |
10.C2H5OH、CH4、C3H8、C是常用的燃料,它们每1mol分别完全燃烧时,前三种生成CO2(g)及H2O(l),最后一种生成CO2(g),放出的热量依次为1366.8kJ、890.3kJ、2219.9kJ、393.5kJ.相同质量的这四种燃料,完全燃烧时放出热量最少的是( )
| A. | C2H5OH | B. | CH4 | C. | C3H8 | D. | C |
20.设NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 足量的Zn与一定量的浓H2SO4反应,标况下产生22.4L气体,转移电子数一定为2NA | |
| B. | lmolC12参加反应转移的电子数一定为2NA | |
| C. | 将含0.lmolFeCl3的饱和溶液滴入一定量的沸水中得到Fe(OH)3胶体,其胶体微粒为0.lNA | |
| D. | 50mL,l2 mo1•L-1的盐酸与足量MnO2共热,转移电子数为0.3NA |
7.Q、W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,X的焰色呈黄色.五种元素核电荷数之和为54,最外层电子数之和为20.W、Z最外层电子数相同,Z的核电荷数是W的2倍.工业上一般通过电解氧化物的方法获得Y的单质.则下列说法不正确的是( )
| A. | 原子半径:X>Y>Q>W | |
| B. | X、Y对应的简单离子的氧化性:Xm+>Yn+ | |
| C. | Q和Z所形成的分子空间构型为直线形 | |
| D. | Q和W可形成原子个数比为1:1和2:1的化合物 |
5.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 78 g苯含有的C=C键数目为3NA | |
| B. | lmol C10H20分子中共用电子对总数为31 NA | |
| C. | 1 L 1 mol•L-1苯酚钠溶液中含有  的个数为NA 的个数为NA | |
| D. | 1mol甲烷与足量氧气发生反应,转移电子数为8 NA |