题目内容
6.在相同条件下,取盐酸和醋酸溶液各100mL,与足量锌粉充分反应,若醋酸与锌反应放出的氢气多,则反应前( )| A. | 两者H+浓度可能均为0.01 mol/L | |
| B. | 两者的浓度均为0.01 mol/L | |
| C. | 醋酸中H+浓度一定大于盐酸中H+浓度 | |
| D. | 盐酸浓度一定大于醋酸浓度 |
分析 醋酸弱电解质,盐酸为强酸,等体积的两溶液与与足量锌粉充分反应,若醋酸与锌反应放出的氢气多,说明醋酸的浓度较大,无法判断两溶液中氢离子浓度大小,据此进行解答.
解答 解:醋酸弱电解质,盐酸为强酸,等体积的两溶液与与足量锌粉充分反应,若醋酸与锌反应放出的氢气多,说明醋酸的浓度较大,
A.两者H+浓度均为0.01mol/L时,醋酸的浓度大于0.01mol/L,与足量锌粉充分反应,若醋酸与锌反应放出的氢气多,故A正确;
B.两者的浓度均为0.01 mol/L时,与足量锌粉充分反应后生成氢气的量相等,故B错误;
C.醋酸的浓度大于盐酸即可,醋酸中H+浓度不一定大于盐酸中H+浓度,故C错误;
D.根据分析可知,醋酸的浓度越大大于盐酸,故D错误;
故选A.
点评 本题考查了化学方程式的计算,题目难度不大,明确弱电解质的电离特点为解答关键,注意掌握发生反应实质,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.将一定量的SO2(g)和O2(g)分别通入体积为2L的恒容密闭容器中,在不同温度下进行反应:2SO2(g)+O2(g)?2SO3(g)△H<0.得到如表中的两组数据:下列说法不正确的是( )
| 实验编号 | 温度/℃ | 平衡常数/mol-1•L | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| SO2 | O2 | SO2 | O2 | ||||
| 1 | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
| 2 | T2 | K2 | 4 | 2 | 0.4 | y | t |
| A. | 实验1在前6min的平均反应速率υ(SO2)=0.2 mol•L-1•min-1 | |
| B. | T1、T2的关系:T1>T2 | |
| C. | K1、K2的关系:K2>K1 | |
| D. | x=1.6,y=0.2,t<6 |
1.在某恒容密闭容器中投入X、Y、W、Q四种物质,经一段时间后测得各物质的物质的量如表所示:
上述容器中发生的化学反应方程式可能是( )
| X | Y | W | Q | |
| 10min | 1.0mol | 3.0mol | 1.0mol | 2.0mol |
| 20min | 0.5mol | 1.5mol | 2.0mol | 1.0mol |
| A. | X+2Y═2W+2Q | B. | 3X+Y+2W═2Q | C. | X+3Y+2Q═2W | D. | X+2Y+3Q═2W |
15.化学与社会、生活密切相关.对下列现象或事实的解释正确的是( )
| 选项 | 现象或事实 | 解释 |
| A | 用浸有酸性高锰酸钾溶液的硅藻土作水果保鲜剂 | 酸性高锰酸钾溶液能氧化水果释放的催熟剂乙烯 |
| B | 用氢氟酸蚀刻玻璃 | SiO2是碱性氧化物,能溶于酸 |
| C | 过氧化钠作呼吸面具中的供氧剂 | 过氧化钠是强氧化剂,能氧化二氧化碳 |
| D | Al(OH)3用作塑料的阻燃剂 | Al(OH)3受热熔化放出大量的热 |
| A. | A | B. | B | C. | C | D. | D |
16.在浓碱作用下,苯甲醛自身可发生反应制备相应的苯甲酸 ( 在碱溶液中生成羧酸盐 ) 和苯甲醇,反应后静置,液体出现分层现象.有关物质的物理性质如表:下列说法不正确的是( )
| 苯甲醛 | 苯甲酸 | 苯甲醇 | |
| 沸点/℃ | 178.1 | 249.2 | 205.4 |
| 熔点/℃ | -26 | 121.7 | -15.3 |
| 溶解性 ( 常温 ) | 微溶于水,易溶于有机溶剂 | ||
| A. | 苯甲醛既发生了氧化反应,又发生了还原反应 | |
| B. | 可用银氨溶液判断反应是否完全 | |
| C. | 反应后的溶液先用分液法分离出有机层,再用蒸馏法分离出苯甲醇 | |
| D. | 反应后的溶液中加酸、酸化后,用过滤法分离出苯甲酸 |
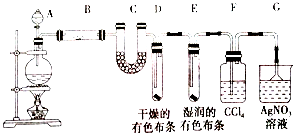
 +
+ $\stackrel{△}{→}$
$\stackrel{△}{→}$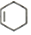
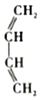
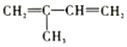 的名称是2-甲基-1,3-丁二烯.
的名称是2-甲基-1,3-丁二烯. b.
b. c.
c.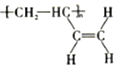
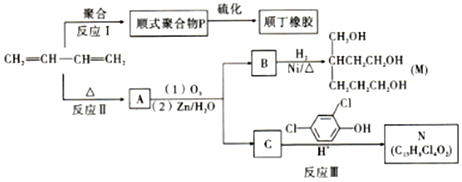
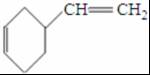 ;反应III的化学方程式是
;反应III的化学方程式是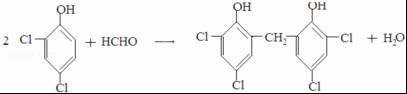 ;1molB完全转化成M所消耗H2的质量是6g.
;1molB完全转化成M所消耗H2的质量是6g.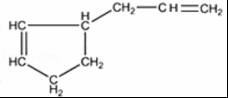 .
.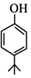 ,同时满足下列条件的X的同分异构体共有26种.(①苯环上有三个取代基 ②能与FeCl3溶液显色)写出其中苯环上只有两种不同化学环境氢原子的两种异构体的结构简式:
,同时满足下列条件的X的同分异构体共有26种.(①苯环上有三个取代基 ②能与FeCl3溶液显色)写出其中苯环上只有两种不同化学环境氢原子的两种异构体的结构简式: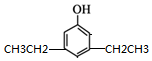 、
、 .
.