题目内容
16.碱金属能形成离子型氢化物.如氢化钠的化学式为NaH,其中H-具有较强的还原性.(1)NaH能与水剧烈反应生成对应的碱和氢气,反应的化学方程式为NaH+H2O=NaOH+H2↑,用双线桥法标出该反应电子转移的方向和数目
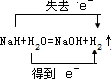 ,若该反应生成标况下氢气11.2L,则此时反应转移的电子数目是0.5NA.
,若该反应生成标况下氢气11.2L,则此时反应转移的电子数目是0.5NA.(2)常用NaH在高温下将TiCl4还原成Ti,反应的化学方程式为TiCl4+4NaH$\frac{\underline{\;高温\;}}{\;}$Ti+4NaCl+2H2↑,氧化剂是TiCl4,还原产物是Ti.
分析 (1)NaH与水反应生成NaOH和氢气,只有H元素的化合价变化;
(2)NaH与TiCl4反应生成Ti和NaCl,Ti元素的化合价降低,Na元素的化合价升高.
解答 解:(1)NaH与水反应生成NaOH和氢气,反应为NaH+H2O=NaOH+H2↑,反应物NaH中H元素化合价由-1价升高到0价,水中H元素化合价由+1价降低到0价,每生成1mol氢气,则转移1mol电子,则若该反应生成标况下氢气11.2L,即0.5mol,则转移0.5mol电子,即0.5NA,该反应电子转移的方向和数目可用双线桥法表示为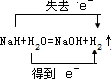 ,
,
故答案为:NaH+H2O=NaOH+H2↑;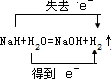 ;0.5NA;
;0.5NA;
(2)NaH与TiCl4反应生成Ti和NaCl,反应为TiCl4+4NaH$\frac{\underline{\;高温\;}}{\;}$Ti+4NaCl+2H2↑,Ti元素的化合价降低,则为氧化剂,Na元素的化合价升高,Na为还原剂,还原产物为Ti,
故答案为:TiCl4+4NaH$\frac{\underline{\;高温\;}}{\;}$Ti+4NaCl+2H2↑;TiCl4;Ti.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,题目难度不大.

练习册系列答案
相关题目
7.下列有机反应属于加聚反应的是( )
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | B. |  | ||
| C. |  | D. | 2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ |
4.已知在一定条件下,二个氨基酸分子之间失去一分子水,缩合生成“二肽”.现将甘氨酸[CH2(NH2)-COOH]和丙氨酸[CH3-CH(NH2)-COOH]组成的混合物,在一定条件下发生缩合反应,生成的“二肽”可能有( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
11.相同条件下,①氯化钠溶液 ②醋酸钠溶液 ③碳酸钠溶液 ④碳酸氢钠溶液,它们的PH相对大小为( )
| A. | ④>③>②>① | B. | ③>④>②>① | C. | ②>③>④>① | D. | ③>②>④>① |
1.实验室制Cl2的反应如下:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,下列有关该反应的说法正确的是( )
| A. | MnO2是还原剂 | B. | HCl被氧化 | ||
| C. | MnO2发生氧化反应 | D. | 每反应4molHCl转移4mol电子 |
8.下列有关化学用语能确定为丙烯的是( )
| A. |  | B. | C3H6 | C. |  | D. | CH2CHCH3 |
5.1mol过氧化钠与2mol碳酸氢钠固体混合后,在密闭的容器中加热充分反应,排出气体物质后冷却,残留的固体物质是( )
| A. | Na2CO3、Na2O2 | B. | Na2CO3 | ||
| C. | NaOH、Na2CO3 | D. | Na2O2、NaOH、Na2CO3 |