题目内容
5.1mol过氧化钠与2mol碳酸氢钠固体混合后,在密闭的容器中加热充分反应,排出气体物质后冷却,残留的固体物质是( )| A. | Na2CO3、Na2O2 | B. | Na2CO3 | ||
| C. | NaOH、Na2CO3 | D. | Na2O2、NaOH、Na2CO3 |
分析 碳酸氢钠不稳定受热分解,方程式:2NaHCO3 $\frac{\underline{\;加热\;}}{\;}$Na2CO3+CO2↑+H2O,可知1mol碳酸氢钠分解生成0.5moNa2CO3、0.5molCO2、0.5molH2O,然后过氧化钠分别与水和二氧化碳反应,确定最后的固体的物质.
解答 解:碳酸氢钠不稳定受热分解,方程式:2NaHCO3 $\frac{\underline{\;加热\;}}{\;}$Na2CO3+CO2↑+H2O,1mol碳酸氢钠分解生成0.5moNa2CO3、0.5molCO2、0.5molH2O,
则:2NaHCO3 $\frac{\underline{\;加热\;}}{\;}$Na2CO3+CO2↑+H2O,
2mol 1mol 1mol 1mol
2Na2O2+2CO2═2Na2CO3+O2,
1mol 1mol 1mol
则过氧化钠恰好与碳酸氢钠分解生成的二氧化碳反应,排出气体物质后冷却,残留的固体物质为2molNa2CO3,
故选:B.
点评 本题考查钠的化合物的重要性质,明确碳酸氢钠的性质及过氧化钠与二氧化碳、与水的反应及反应的先后顺序是解答本题的关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.我国“嫦娥Ⅱ号”成功进入月球轨道.据科学家预测,月球的土壤中吸附着数百万吨的${\;}_{2}^{3}$He,每百吨${\;}_{2}^{3}$He核聚变所释放出的能量相当于目前人类一年消耗的能量.在地球上,氦元素主要以${\;}_{2}^{3}$He的形式存在.下列说法正确的是( )


| A. | ${\;}_{2}^{3}$He核聚变是化学变化 | |
| B. | ${\;}_{2}^{3}$He和42He互为同素异形体 | |
| C. | ${\;}_{2}^{3}$He原子核内含仅含有1个中子 | |
| D. | ${\;}_{2}^{4}$He的最外层电子数为2,所以易失电子 |
13.A元素原子得电子变成阴离子释放出的能量比B元素原子得电子变成阴离子释放出的能量大,则( )
| A. | 氧化性A->B- | B. | 还原性 A->B- | C. | 氧化性 A>B | D. | 还原性A>B |
20.用下列装置能达到有关实验目的是( )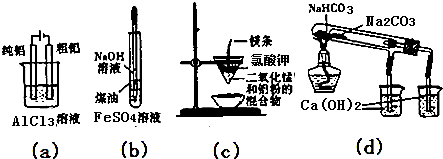

| A. | 用图(a)装置电解精炼铝 | |
| B. | 用图(b)装置制备Fe(OH)2 | |
| C. | 图(c)装置可制得金属钾 | |
| D. | 图(d)验证NaHCO3和Na2CO3的热稳定性 |
14.下列物质能够导电且属于电解质的是( )
①熔融的氯化钠
②硝酸钾溶液
③硫酸铜晶体
④无水乙醇.
①熔融的氯化钠
②硝酸钾溶液
③硫酸铜晶体
④无水乙醇.
| A. | ① | B. | ①② | C. | ①②③ | D. | ④ |
15.将绿豆大小的金属钠投入加有酚酞的100mL蒸馏水中,则( )
| A. | 溶液变蓝 | B. | Na浮在水面上并熔化成小球 | ||
| C. | Na在水面上游动 | D. | 有H2生成 |
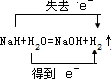 ,若该反应生成标况下氢气11.2L,则此时反应转移的电子数目是0.5NA.
,若该反应生成标况下氢气11.2L,则此时反应转移的电子数目是0.5NA.