题目内容
对于Ag2S(s)?2Ag++S2-,其Ksp的表达式为 .
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:
分析:依据沉淀溶解平衡的溶度积常数表示方法写出,溶度积Ksp等于溶液中离子浓度幂次方乘积.
解答:
解:对于沉淀溶解平衡:Ag2S(s)?2Ag+(aq)+S2-(aq),一定温度下的饱和溶液中存在溶度积常数,Ksp=c(Ag+)2?c(S2-),
故答案为:Ksp=c(Ag+)2?c(S2-);
故答案为:Ksp=c(Ag+)2?c(S2-);
点评:本题考查了难溶电解质的溶度积ksp的表达式的书写,难度不大,根据溶度积Ksp等于溶液中离子浓度幂次方乘积书写即可.

练习册系列答案
相关题目
下列各项操作中,发生“先产生沉淀,后沉淀又溶解”现象的是( )
①向AlCl3溶液中通入过量的NH3
②向Fe(OH)3胶体中逐滴加入过量的稀硫酸
③向水玻璃中逐滴加入过量的盐酸
④向Ca(OH)2溶液中通入过量的CO2.
①向AlCl3溶液中通入过量的NH3
②向Fe(OH)3胶体中逐滴加入过量的稀硫酸
③向水玻璃中逐滴加入过量的盐酸
④向Ca(OH)2溶液中通入过量的CO2.
| A、②④ | B、①④ | C、①③ | D、①② |
 常温下,向20mL 0.2mol?L-1 H2A溶液中滴加0.2mol?L-1NaOH溶液.有关微粒的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2- ).根据图示判断,下列说法正确的是
常温下,向20mL 0.2mol?L-1 H2A溶液中滴加0.2mol?L-1NaOH溶液.有关微粒的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2- ).根据图示判断,下列说法正确的是( )
| A、当V(NaOH)=20 mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) |
| B、等体积等浓度的NaOH溶液与H2A溶液混合后其溶液中水的电离程度比纯水大 |
| C、A点溶液显中性 |
| D、向NaHA溶液加入水的过程中,pH可能增大也可能减小 |
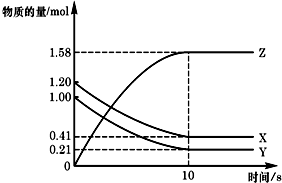 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )| A、应开始到10 s时,Y的转化率为79.0% |
| B、应的化学方程式为:X(g)+Y(g)=Z(g) |
| C、应开始到10 s,用Z表示的反应速率为0.158mol/(L?s) |
| D、开始到10 s,X的物质的量浓度减少了0.79mol/L |
向浅绿色的Fe(NO3)2溶液中,逐滴加入稀盐酸,溶液的颜色变化是( )
| A、变成无色 | B、变成深绿色 |
| C、没有改变 | D、变成棕黄色 |
常温下,若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能是( )
| A、生成了一种强酸弱碱盐 |
| B、强酸溶液和弱碱溶液反应 |
| C、弱酸溶液和强碱溶液反应 |
| D、一元强酸溶液和一元强碱溶液反应 |
将黄豆粒大小的金属钠置于一铝片上,在铝片上用酒精灯加热至钠充分燃烧,移去酒精灯后,在铝片上有淡黄色粉末生成.过一段时间后,铝片上的淡黄色粉末变成带有白色泡沫的潮湿液体.以下有关该实验的叙述错误的是( )
| A、上述实验过程中的变化都是氧化还原反应 |
| B、上述实验过程中产生的泡沫里存在混合气体 |
| C、上述实验过程中还存在反应:Al2O3+2NaOH═2NaAlO2+H2O |
| D、上述实验过程中还存在反应:2Al+2NaOH+2H2O═2NaAlO2+3H2↑ |
 目前工业上可用CO2来生产燃料甲醇,其反应方程式为:CO2(g)+
目前工业上可用CO2来生产燃料甲醇,其反应方程式为:CO2(g)+ 的分子式
的分子式 1mol最多能与
1mol最多能与 中,共平面的碳原子最多有
中,共平面的碳原子最多有