题目内容
3.纳米技术是正在崛起的新科技,它研究的粒子直径在1~100nm之间.在此范围内物质的性质发生很大变化.例如Cu的直径加工成几个纳米时,会在空气中剧烈燃烧.纳米TiO2是理想的光催化剂,光照时在常温下可将汽车尾气中氮、硫的氧化物氧化成相应的酸,它还可以将废水中的有害物质快速氧成CO2和H20、作抗菌材料等.以下有关说法中正确的是( )| A. | 纳米铜比纳米铁金属活动性更强 | |
| B. | 纳米铜在反应中可能作氧化剂 | |
| C. | 纳米TiO2在不同溶剂中均形成了胶体 | |
| D. | 纳米TiO2有很强的氯化性 |
分析 A.Cu不如Fe活泼;
B.纳米铜在反应中失去电子,作还原剂;
C.TiO2与CCl4等氯化试剂的反应;
D.根据将氮、硫的氧化物氧化成相应的酸,消毒抗菌分析.
解答 解:A.Cu不如Fe活泼,因此纳米铜比纳米铁金属活动性更弱,故A错误;
B.纳米铜在反应中失去电子,可作还原剂,故B错误;
C.纳米TiO2与CCl4等氯化试剂的反应,因此在CCl4等氯化试剂中不能形成胶体,故C错误;
D.纳米TiO2将氮、硫的氧化物氧化成相应的酸,消毒抗菌,体现了纳米TiO2具有的氧化性,故D正确;
故选D.
点评 本题考查了纳米材料,涉及物质的性质和胶体的性质,难度不大,注意物质的化学性质与颗粒的大小无直接联系.

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目
11.甲、乙两个密闭容器中均发生反应:C(s)+2H2O(g)?CO2(g)+2H2(g)△H>0.有关实验数据如下表所示:
下列说法正确的是( )
容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | 平衡常数 | |
| C(s) | H2O(g) | H2(g) | |||||
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 3.5 | K1 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 | 3 | K2 |
| A. | T1<T2 | |
| B. | K2=1.35 mol•L-1(或K2=1.35) | |
| C. | 混合气体的密度始终保持不变 | |
| D. | 乙容器中,当反应进行到1.5 min时,n(H2O)=1.4 mol. |
8.以下实验能获得成功的是( )
| A. | 用酸性KMn04溶液鉴别乙烯和乙炔 | |
| B. | 将铁屑、溴水、苯混合制溴苯 | |
| C. | 苯和硝基苯采用分液的方法分离 | |
| D. | 分离沸点相差30℃以上的混溶液体,采用蒸馏的方法 |
15.NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,11.2L苯含有的分子数为0.5NA | |
| B. | 3.2gCH4含有的化学键数为0.4NA | |
| C. | 足量的O2与1molNa充分反应,转移的电子数为NA | |
| D. | 25℃时,1.0LpH=13的Ba(0H)2溶液中含有的0H-数为0.2NA |
15.下列说法正确的是( )
| A. | pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+)>c(OH-)=c(H+) | |
| B. | 0.2mol/L的CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合:2c(Na+)=c(CH3COO-) | |
| C. | 浓度均为0.10mol/L的氨水和氯化铵溶液等体积混合后:c(NH3•H2O)+c(NH4+)=0.1mol/L | |
| D. | pH=3的盐酸和pH=11的氢氧化钡等体积混合pH>7 |
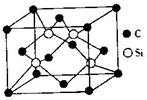 氮化硅是一种重要的结构陶瓷材料,具有优良性能.
氮化硅是一种重要的结构陶瓷材料,具有优良性能.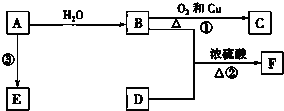 已知A的产量通常用来衡量一个国家的石油化工发展水平,B、D是饮食中两种常见的有机物,F是一种有香味的物质,F中碳原子数是D的两倍.现以A为主要原料合成F和高分子化合物E,其合成路线如图所示.
已知A的产量通常用来衡量一个国家的石油化工发展水平,B、D是饮食中两种常见的有机物,F是一种有香味的物质,F中碳原子数是D的两倍.现以A为主要原料合成F和高分子化合物E,其合成路线如图所示.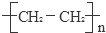 ,反应类型:加聚反应.
,反应类型:加聚反应.
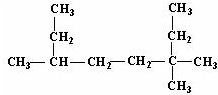 的名称为3,3,6-三甲基辛烷;
的名称为3,3,6-三甲基辛烷;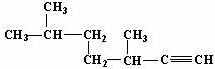 的名称为3,6-二甲基-1-庚炔;
的名称为3,6-二甲基-1-庚炔;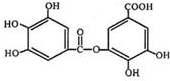 中含氧官能团的名称为羟基、羧基、酯基.
中含氧官能团的名称为羟基、羧基、酯基.