题目内容
16.一水硫酸四氨合铜(II)的化学式为SO4•H2O合成路线如图1:
己知:2+(aq)?Cu2+(aq)+4NH3(aq);(NH4)2SO4在水中可溶,在乙醇中难溶;SO4•H2O在乙醇水混合溶剂中的溶解度随乙醇体积分数的变化曲线示意图如图2:
(1)流程图中气体X的主要成分SO2(O2)(填化学式),步骤1需要加什么酸硫酸(填名称).
(2)有同学提出:从溶液D到产品的步骤2,可以采用的操作方法依次是:加热蒸发、冷却结晶、抽滤、洗涤、干燥.请评价其合理性,并说明理由不合理,加热蒸发,温度升高,NH3放出,会促进[Cu(NH3)4]2+(aq)?Cu2+(aq)+4NH3(aq)平衡正移,Cu2+水解,使得到的产物晶体会含有杂质[Cu(OH)2或Cu2(OH)2SO4等;请另外再提出一种合理的实验方案向溶液D中加入适量乙醇,再过滤、洗涤、干燥(不要求具体的实验步骤).
(3)抽滤装置如图3所示,该装置中的错误之处是布氏漏斗的瓶口斜面未朝向抽滤瓶的支管口;抽滤完毕或中途需停止抽滤时,应先断开连接安全瓶与抽气装置间的橡皮管,然后关闭抽气装置中的水龙头.
分析 辉铜矿Cu2S(主要杂质Fe3O4)通入氧气充分煅烧,发生反应:Cu2S+2O2$\frac{\underline{\;高温\;}}{\;}$2CuO+SO2,则气体X为二氧化硫与过量的氧气,固体B为CuO、Fe3O4,加入硫酸得到含有Cu2+、Fe3+的溶液,加入过量氨水,可得到[Cu(NH3)4]2+和Fe(HO)3,过滤,向含有[Cu(NH3)4]2+的滤液中加入适量乙醇,再过滤、洗涤、干燥,得产品一水硫酸四氨合铜,据此分析作答.
解答 解:(1)辉铜矿通入氧气充分煅烧,发生反应:Cu2S+2O2$\frac{\underline{\;高温\;}}{\;}$2CuO+SO2,则气体X为二氧化硫与过量的氧气,固体B为CuO、Fe3O4,经过步骤1得到含有Cu2+、Fe3+的溶液,为不引入杂质,故应加硫酸;
故答案为:SO2(O2);硫酸;
(2)溶液D为含有[Cu(NH3)4]2+的溶液,加热蒸发,温度升高,NH3放出,会促进2+(aq)?Cu2+(aq)+4NH3(aq)平衡正移,Cu2+水解,使得到的产物晶体会含有杂质Cu(OH)2或Cu2(OH)2 SO4等;由题);Cu(NH3)2SO4在水中可溶,在乙醇中难溶,向溶液D中加入适量乙醇,再过滤、洗涤、干燥;
故答案为:不合理,加热蒸发,温度升高,NH3放出,会促进[Cu(NH3)4]2+(aq)?Cu2+(aq)+4NH3(aq)平衡正移,Cu2+水解,使得到的产物晶体会含有杂质[Cu(OH)2或Cu2(OH)2 SO4等;向溶液D中加入适量乙醇,再过滤、洗涤、干燥;
(3)题目图3所示装置为抽滤装置,装置中存在的错误是:布氏漏斗的颈口斜面未朝向抽滤瓶的支管口,这样不利于吸滤.抽滤完毕或中途停止抽滤时,应先断开连接安全瓶与抽气装置间的橡皮管,然后关闭抽气装置中的水龙头;
故答案为:布氏漏斗的瓶口斜面未朝向抽滤瓶的支管口;断开连接安全瓶与抽气装置间的橡皮管,关闭抽气装置中的水龙头.
点评 本题考查物质的制备,为高考常见题型,侧重于学生的分析能力、实验能力的考查,题目涉及化学平衡移动、结晶方式的分析等,弄清实验原理、目的、要求、步骤和注意事项是解题的关键,中等难度.

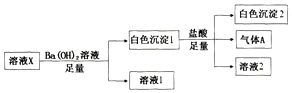 某溶液X中可能含有下列离子中的若干种:Cl-、SO42-、SO32-、HCO3-、Na+、Mg2+、Fe3+,所含离子的物质的量浓度均相同.为了确定该溶液的组成,某同学取100mL上述溶液X,进行了如图实验:下列说法正确的是( )
某溶液X中可能含有下列离子中的若干种:Cl-、SO42-、SO32-、HCO3-、Na+、Mg2+、Fe3+,所含离子的物质的量浓度均相同.为了确定该溶液的组成,某同学取100mL上述溶液X,进行了如图实验:下列说法正确的是( )| A. | 气体A可能是CO2或SO2 | |
| B. | 溶液X中一定存在SO42-、HCO3-、Na+、Mg2+ | |
| C. | 溶液X中一定不存在Fe3+和Mg2+,可能存在Na+ | |
| D. | 分别在溶液1和溶液2中加入硝酸酸化的硝酸银溶液都能生成白色沉淀 |
| A. | Al2O3作耐火材料是因为氧化铝熔点高 | |
| B. | “血液透析”利用了胶体的性质 | |
| C. | 糖类、油脂、蛋白质均能发生水解 | |
| D. | 家用燃煤中适量的生石灰能有效减少二氧化硫的排放 |
| A. | 化合物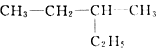 的名称是2-乙基丁烷 的名称是2-乙基丁烷 | |
| B. | 2-甲基丁烷和2,2-二甲基丙烷互为同系物 | |
| C. | 常温下,乙烯和苯都能被酸性KMnO4氧化,使KMnO4溶液褪色 | |
| D. | 等物质的量的乙烯和乙醇完全燃烧,消耗氧气的物质的量相等 |
| A. | 氢气 | B. | 石油 | C. | 沼气 | D. | 酒精 |
①HCl、NaOH、AlCl3 ②Na2CO3、NaHCO3、NaHSO4
③FeCl2、Fe2(SO4)3、AgNO3 ④CuSO4、Al2(SO4)3、Na2CO3.
| A. | ①②③④ | B. | 仅①②③ | C. | 仅①③④ | D. | 仅②③④ |
| A. | 中子数为16的硫原子:${\;}_{32}^{48}$S | B. | Cl的结构示意图: | ||
| C. | 甲酸甲酯的结构简式:HCOOCH3 | D. | 氢氧化钠的电子式: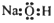 |
 的命名正确的是( )
的命名正确的是( )| A. | 3-甲基-3-丁烯 | B. | 3-甲基-2-丁烯 | C. | 2-甲基-2-丁烯 | D. | 2-甲基-2-戊烯 |

 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$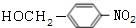 +NaCl.
+NaCl.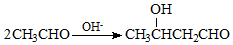 .
.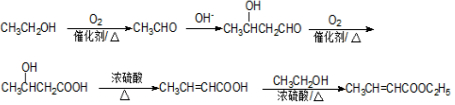 .
.