题目内容
8.室温下,溶质的物质的量浓度均为0.1mol/L,下列各组物质的溶液,不用其他试剂(包括各种试纸)即可鉴别的是( )①HCl、NaOH、AlCl3 ②Na2CO3、NaHCO3、NaHSO4
③FeCl2、Fe2(SO4)3、AgNO3 ④CuSO4、Al2(SO4)3、Na2CO3.
| A. | ①②③④ | B. | 仅①②③ | C. | 仅①③④ | D. | 仅②③④ |
分析 不用其它试剂即可鉴别,则相互之间反应的现象不同;反之,现象相同时不能鉴别,以此来解答.
解答 解:①相互滴定,先有沉淀后沉淀消失则所加的是NaOH溶液,被滴定的为AlCl3,生成的氢氧化铝可鉴别HCl,可鉴别,故正确;
②Na2CO3、NaHCO3都可与NaHSO4反应生成气体,但现象不同,Na2CO3开始反应时没有气体生成,可鉴别,故正确;
③FeCl2、Fe2(SO4)3溶液颜色不同,可鉴别,故正确;
④CuSO4溶液呈蓝色,与Na2CO3反应生成沉淀,可鉴别,故正确.
故选A.
点评 本题考查物质鉴别和检验,为高频考点,把握物质的性质与发生的反应和现象为解答的关键,侧重分析与应用能力考查,注意元素化合物知识的综合应用,题目难度不大.

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
18.在盛放浓硫酸的试剂瓶的标签上应印有下列警示标记中的( )
| A. |  | B. |  | C. |  | D. |  |
19.下列有关电解质溶液的说法正确的是( )
| A. | 浓度均为0.1 mol•L-1的①(NH4)2CO3②(NH4)2SO4③(NH4)2Fe(SO4)2溶液中,c(NH4+)的大小顺序为:③<②<① | |
| B. | 工业上常用Na2SO3溶液作为吸收液脱除烟气中的SO2,随着SO2的吸收,吸收液的pH不断变化.当吸收液呈酸性时:c (Na+)=c (SO32-)+c (HSO3-)+c (H2SO3) | |
| C. | 常温下,将0.1 mol•L-1 CH3COOH溶液加水稀释,当溶液的pH从3.0升到5.0时,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的值增大到原来的100倍 | |
| D. | 向0.2 mol/LNaHCO3溶液中加入等体积0.1 mol/L NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
3.下列说法不正确的是( )
| A. | HCOOH 和 CH3COOH 互为同系物 | |
| B. | 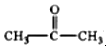 与CH3CH2CHO互为同分异构体 与CH3CH2CHO互为同分异构体 | |
| C. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{80}$Br | |
| D. | 烷烃CH3CH(CH3)C(CH3)3的名称是2,3,3-三甲基丁烷 |
13.明代《本草纲目》记载了民间酿酒的工艺“凡酸坏之酒,皆可蒸烧”,“以烧酒复烧二次…价值数倍也”.这里用到的实验方法可用于分离( )
| A. | 汽油和氯化钠溶液 | B. | 39%的乙醇溶液 | ||
| C. | 氯化钠与单质溴的水溶液 | D. | 硝酸钾和氯化钠的混合物 |
20.根据下列实验操作和现象所得到的结论正确的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 向蔗糖中加入浓硫酸 | 蔗糖变成疏松多孔的海绵状 | 浓硫酸具有吸水性和强氧化性 |
| B | 将0.1mol/LMgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol/LCuSO4溶液 | 先有白色沉淀生成后变为浅蓝色沉淀 | Cu(OH)2的溶解度比Mg(OH)2的小 |
| C | FeCl3和BaCl2混合溶液中通入足量SO2 | 溶液变为浅绿色且有白色沉淀生成 | Fe3+被还原为Fe2+,沉淀为BaSO3 |
| D | 常温下,将铁片浸入足量浓硫酸中 | 铁片上无明显现象 | 常温下,铁与浓硫酸没有发生化学反应 |
| A. | A | B. | B | C. | C | D. | D |
4.下列装置,操作正确的是( )
| A. |  用图装置加热氯化铵溶液制取氯化铵晶体 | |
| B. | 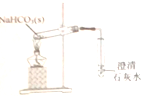 用图装置探究NaHCO3的热稳定 | |
| C. | 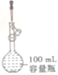 用图装置溶解氯化钠配制100mL1mol•L-1NaCl溶液 | |
| D. |  用图装置比较硫、碳、硅三种元素的非金属性强弱 |
5.Mg-AgCl电池是一种以海水为电解质溶液的水激活电池.下列叙错误的是( )
| A. | 负极反应式为Mg-2e-=Mg2+ | |
| B. | 正极反应式为Ag+e-=Ag | |
| C. | 电池放电时Cl-由正极向负极迁移 | |
| D. | 电池放电时,外电路中,电子由负极向正极移动 |
