题目内容
12.合理使用药物有利于身心健康.下列有关说法正确的是( )| A. | 氯化钠用于治疗胃酸过多 | |
| B. | 阿司匹林常用于解热镇痛 | |
| C. | 青霉素是一种常用的抗生素,使用前没有必要进行皮肤敏感实验 | |
| D. | 非处方药都无毒副作用,可长期大量服用 |
分析 A.治疗胃酸过多的药物应能与盐酸反应;
B.阿司匹林是解热镇痛药;
C.青霉素使用前要进行皮肤敏感实验;
D.药物一般都有一定的毒副作用,包括补药,要根据自身的实际需要服用.
解答 解:A.氯化钠与盐酸不反应,不能用于治疗胃酸过多,故A错误;
B.阿司匹林是解热镇痛药,常用于解热镇痛,故B正确;
C.青霉素是常见的抗生素,使用前要进行皮肤敏感实验,故C错误;
D.药物一般都有一定的毒副作用,长期大量服用,会危害人体健康,故D错误.
故选B.
点评 本题考查药物的成分和服药注意事项,难度不大,注意药物一般都有一定的毒副作用,包括补药,要根据自身的实际需要服用.

练习册系列答案
相关题目
3.下列过程属于熵增加的是( )
| A. | 一定条件下水由气态变为液态 | |
| B. | 高温高压条件下使石墨转化为金刚石 | |
| C. | 有序排列的火柴散落 | |
| D. | CO点燃时生成CO2 |
20.某反应2C(g)?A(g)+2B(g)△H<0,下列判断正确的是( )
| A. | 任何温度下反应均难以自发进行 | B. | 任何温度下反应均可以自发进行 | ||
| C. | 仅常温下反应可以自发进行 | D. | 仅高温下反应可以自发进行 |
7.在下列各反应中,盐酸既表现出酸性又表现出氧化性的是( )
| A. | HCI+NaOH═NaCl+H2O | |
| B. | Zn+2HCl═ZnCl2+H2↑ | |
| C. | HCl+AgNO3═AgCl↓+HNO3 | |
| D. | MnO2+4HCI (浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+C12↑+2H2O |
17.NaHS、MgSO4、NaHSO4三种物质组成的混合物中,己知氧元素的质量分数为a%,则其中硫元素的质量分数为( )
| A. | a% | B. | 1-1.75% | C. | 4(l-a%)7 | D. | 3(l-a%)7 |
4.同温、同压下,决定气体体积的主要因素是( )
| A. | 气体分子的直径 | B. | 气体分子间的平均距离 | ||
| C. | 气体的分子数目 | D. | 气体分子的摩尔质量 |
7. 氨催化氧化是硝酸工业的基础,按要求回答下列问题:
氨催化氧化是硝酸工业的基础,按要求回答下列问题:
(1)NH3与O2可生成NO,其热化学方程式可表示为:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H
已知几种化学键的键能如表:
①由此计算得出△H=12x+5n-4y-12m (用上表中字母表示)kJ•mol-1.
②400℃时,在1L的密闭容器中加入l mol NH3和1.5mol O2,测得平衡时容器的压强为p,且比反应前压强增大了4%,则该温度下NH3的转化率为40%;该反应的平衡常数Kp=3.545×10-3p(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数);达到平衡后,保持温度不变,将反应容器的体积增大一倍,平衡向正反应(填“正反应”或“逆反应”)方向移动,判断理由是对气体分子数增大的反应,减小压强平衡向正反应方程移动.
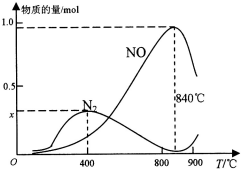
(2)实际反应中,在上述1L的密闭容器中加入l mol NH3和1.5mol O2的反应过程中还发生4NH3+3O2?N2+6H2O反应,有关温度与各物质的量关系如图所示:
①已知400℃时,混合气体中NH3、N2、NO的物质的量比为5:6:3,则图象中x=0.3.
②NH3生成NO和N2的反应分别属于放热反应、放热反应(填“吸热反应”或“放热反应”),温度高于840℃后,各物质的物质的量发生如图所示变化的原因可能是可能是氨气高温分解生成氮气和氢气,使氨气氧化生成NO平衡向左移动;NO高温分解生成氮气和氧气;氨气和NO反应生成氮气和水(只答一条即可).
 氨催化氧化是硝酸工业的基础,按要求回答下列问题:
氨催化氧化是硝酸工业的基础,按要求回答下列问题:(1)NH3与O2可生成NO,其热化学方程式可表示为:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H
已知几种化学键的键能如表:
| 化学键 | N-H |  | O-H | O=O |
| E/(kJ•mol-1) | x | y | m | n |
②400℃时,在1L的密闭容器中加入l mol NH3和1.5mol O2,测得平衡时容器的压强为p,且比反应前压强增大了4%,则该温度下NH3的转化率为40%;该反应的平衡常数Kp=3.545×10-3p(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数);达到平衡后,保持温度不变,将反应容器的体积增大一倍,平衡向正反应(填“正反应”或“逆反应”)方向移动,判断理由是对气体分子数增大的反应,减小压强平衡向正反应方程移动.
(2)实际反应中,在上述1L的密闭容器中加入l mol NH3和1.5mol O2的反应过程中还发生4NH3+3O2?N2+6H2O反应,有关温度与各物质的量关系如图所示:
①已知400℃时,混合气体中NH3、N2、NO的物质的量比为5:6:3,则图象中x=0.3.
②NH3生成NO和N2的反应分别属于放热反应、放热反应(填“吸热反应”或“放热反应”),温度高于840℃后,各物质的物质的量发生如图所示变化的原因可能是可能是氨气高温分解生成氮气和氢气,使氨气氧化生成NO平衡向左移动;NO高温分解生成氮气和氧气;氨气和NO反应生成氮气和水(只答一条即可).
8.下列实验能成功的是( )
| A. | 用 1体积的乙醇与 3体积的浓 H2SO4混合加热到 140℃制乙烯 | |
| B. | 加入适量浓溴水除去苯中混有的少量苯酚 | |
| C. | 用饱和食盐水和电石(CaC2)制乙炔 | |
| D. | 以盐酸、石灰石、苯酚钠溶液为试剂,验证酸性强弱关系:盐酸>石炭酸>碳酸 |
 甲醇和CO2可直接合成DMC:2CH3OH(g)+CO2 (g)?CH3OCOOCH3 (g)+H2O(g),但甲醇转化率通常不会超过1%,制约该反应走向工业化生产.
甲醇和CO2可直接合成DMC:2CH3OH(g)+CO2 (g)?CH3OCOOCH3 (g)+H2O(g),但甲醇转化率通常不会超过1%,制约该反应走向工业化生产.