题目内容
2. 甲醇和CO2可直接合成DMC:2CH3OH(g)+CO2 (g)?CH3OCOOCH3 (g)+H2O(g),但甲醇转化率通常不会超过1%,制约该反应走向工业化生产.
甲醇和CO2可直接合成DMC:2CH3OH(g)+CO2 (g)?CH3OCOOCH3 (g)+H2O(g),但甲醇转化率通常不会超过1%,制约该反应走向工业化生产.(1)在恒容密闭容器中发生上述反应,能说明反应达到平衡状态的是D(双选).
A.2v正(CH3OH)=v逆(CO2)
B.CH3OH与H2O的物质的量之比保持不变
C.容器内气体的密度不变
D.容器内压强不变
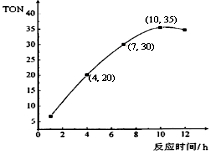
(2)某研究小组在某温度下,在100mL恒容密闭容器中投入2.5mol CH3OH(g)、适量CO2和6×10-5 mol催化剂,研究反应时间对甲醇转化数(TON)的影响,其变化曲线如图所示.
计算公式为:TON=转化的甲醇的物质的量/催化剂的物质的量.在该温度下,最佳反应时间是10h;4~7h内碳酸二甲酯的平均反应速率是1×10-3mol/L•h.
分析 (1)可逆反应达到平衡状态,一定满足正逆反应速率相等且不为零,各组分的浓度不再变化;该反应的特点为:一是可逆反应;二是反应前后气体体积不相等,据此判断反应是否达到平衡状态;
(2)由图可知10h时TON的值最大,依据TON=$\frac{转化的甲醇的物质的量}{催化剂的物质的量}$,计算转化的甲醇的物质的量,结合反应速率还能计算得到甲醇反应速率,反应速率之比等于化学方程式计量数之比得到DMC的平均反应速率;
解答 解:(1)A.同一反应中,用不同物质表示的速率之比等于方程式计量系数之比,所以v正(CO2)=$\frac{1}{2}$v正(CH3OH),而2v正(CH3OH)=v逆(CO2),所以v正(CO2)≠v逆(CO2),反应未达到平衡状态,故A错误;
B.平衡时CH3OCOOCH3与H2O的物质的量之比可能保持不变,也可能变化,所以不能作为达到平衡的判断标准,故B错误;
C.依据ρ=$\frac{m}{V}$可知,反应物生成物都是气体,所以m为定值,恒容容器V不变,则ρ无论是否达到平衡都不变,故C错误;
D.2CH3OH(g)+CO2 (g)?CH3OCOOCH3 (g)+H2O(g),反应前后气体系数和不相等,气体总压不变可以作为判断标志,故D正确;
故选:D;
(2)由图可知10h时TON的值最大;
图象分析,4~7h内TON为10,依据TON=$\frac{转化的甲醇的物质的量}{催化剂的物质的量}$,计算转化的甲醇的物质的量=10×6×10-5 mol=60×10-5mol,反应甲醇的反应速率=
$\frac{\frac{60×1{0}^{-5}mol}{0.1L}}{(7-4)h}$=2×10-3mol/L•h,V(DMC)=$\frac{1}{2}$V(CH3OH)=1×10-3mol/L•h,
故答案为:10h;1×10-3mol/L•h.
点评 本题考查图象分析方法,反应热的计算,平衡影响因素,中等难度,充分运用题中信息是解答本题的关键,题目难度中等.

| A. | 密度一定相同 | B. | 分子数一定相同 | ||
| C. | 原子数一定相同 | D. | 物质的量一定相同 |
| A. | NaOH | B. | Ba(OH)2 | C. | AgNO3 | D. | HCl |
| A. | 液态HCl、固体NaCl均不导电,所以HCl、NaCl均不是电解质 | |
| B. | SO2的水溶液能导电,所以SO2是电解质 | |
| C. | 蔗糖、酒精在水溶液里和熔融状态时均不导电,所以他们不是电解质 | |
| D. | 铜、石墨均导电,所以它们是电解质 |
| A. | Na2SO4=Na2++SO42- | B. | MgCl2=Mg2++Cl- | ||
| C. | HNO3=H++3NO- | D. | Ba(OH)2=Ba2++2OH- |
| A. | 氯化钠用于治疗胃酸过多 | |
| B. | 阿司匹林常用于解热镇痛 | |
| C. | 青霉素是一种常用的抗生素,使用前没有必要进行皮肤敏感实验 | |
| D. | 非处方药都无毒副作用,可长期大量服用 |
 2015年3月,全国“两会”代表委员就我国“雾霾”治理积极建言献策.科学家研究表明氮氧化物与悬浮在大气中的盐粒子相互作用时能产生“二次雾霾”,涉及的反应有:
2015年3月,全国“两会”代表委员就我国“雾霾”治理积极建言献策.科学家研究表明氮氧化物与悬浮在大气中的盐粒子相互作用时能产生“二次雾霾”,涉及的反应有: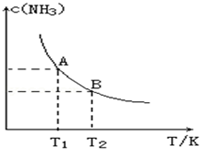 在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为25.0%.
在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为25.0%.