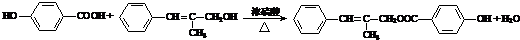题目内容
14.某溶液里加入过量氨水或过量的NaOH溶液均有沉淀产生,若加入铁粉或铜粉溶液质量都增加,则溶液中可能含下列的( )| A. | Al3+ | B. | Fe2+ | C. | Fe3+ | D. | Mg2+ |
分析 当加入NaOH溶液或氨水时,有沉淀生成,选项均符合;另取该化合物的溶液,并加入铁粉或铜粉,溶液的质量将增加,则进入溶液中的质量大于从溶液中析出的质量,以此来解答.
解答 解:A.加入Fe或Cu,不发生反应,溶液质量不变,故A不选;
B.加入Fe或Cu,不发生反应,溶液质量不变,故B不选;
C.加入Fe或Cu,反应生成亚铁离子或亚铁离子和铜离子,不会析出固体,溶液质量增加,故C选;
D.加入Fe或Cu,不发生反应,溶液质量不变,故D不选.
故选C.
点评 本题考查离子的共存,为高考高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,注意利用氧化还原反应分析质量的变化,题目难度不大.

练习册系列答案
相关题目
3.有3种溶液①0.01mol•L-1醋酸; ②0.02mol•L-1醋酸与0.02mol•L-1NaOH等体积混合后的溶液;③0.04mol•L-1醋酸与0.02mol•L-1 NaOH等体积混合后的溶液.下列说法不正确的是( )
| A. | 相同温度下,溶液中水的电离程度:溶液①<溶液② | |
| B. | 可用Na2CO3固体鉴别0.04mol•L-1醋酸和0.04mol•L-1盐酸 | |
| C. | 向①中加入少量CH3COONa固体,则$\frac{{K}_{a}}{c(C{H}_{3}CO{O}^{-})}$增大 | |
| D. | 加水稀释溶液③,溶液中$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$不变 |
5.下列说法正确的是( )
| A. | 在一个基态多电子的原子中,不可能有两个能量完全相同的电子 | |
| B. | M层全充满而N层为4s2的原子与核外电子排布式为1s22s22p63s23p63d64s2的原子位于同一族 | |
| C. | 如果某一基态原子3p能级上仅有2个电子,它们的自旋状态必然相同 | |
| D. | 价电子排布为5s25p1的元素位于第五周期第ⅠA族,是s区元素 |
9.下列各项中表达正确的是( )
| A. | NaCl的电子式: | B. | N2的结构式: | C. | NH4Cl的电子式为 | D. | F-的结构示意图: |
19.下列关于卤素(氟氯溴碘元素,简称为卤素)的叙述正确的是( )
①卤素的钾盐中,所有卤素的化合价均为-1价
②溴中溶有少量氯气,可以用加入溴化钠再用苯萃取的方法提纯
③溴化银具有感光性,碘化银不具有感光性
④某溶液与淀粉KI溶液混合后出现蓝色,则证明该溶液是氯水或溴水
⑤氯气与水溶液反应,一定有酸生成⑥氯气跟水反应时,水既不作氧化剂也不是还原剂.
①卤素的钾盐中,所有卤素的化合价均为-1价
②溴中溶有少量氯气,可以用加入溴化钠再用苯萃取的方法提纯
③溴化银具有感光性,碘化银不具有感光性
④某溶液与淀粉KI溶液混合后出现蓝色,则证明该溶液是氯水或溴水
⑤氯气与水溶液反应,一定有酸生成⑥氯气跟水反应时,水既不作氧化剂也不是还原剂.
| A. | ①③⑤ | B. | ②③⑥ | C. | ②⑤⑥ | D. | ①③④ |
6.某溶液中由水电离出来的氢离子浓度c(H+)=1×10-14mol/L,在这种溶液里可能大量共存的离子组是( )
| A. | Al3+、NH4+、SO42-、Cl- | B. | K+、Fe2+、MnO4-、Cl- | ||
| C. | NH4+、SiO32-、NO3-、K+ | D. | Na+、K+、HCO3-、Mg2+ |
4.有机化合物中的 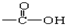 中的-OH被卤原子取代所得的化合物为酰卤,下列化合物中可以看作酰卤的是( )
中的-OH被卤原子取代所得的化合物为酰卤,下列化合物中可以看作酰卤的是( )
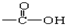 中的-OH被卤原子取代所得的化合物为酰卤,下列化合物中可以看作酰卤的是( )
中的-OH被卤原子取代所得的化合物为酰卤,下列化合物中可以看作酰卤的是( )| A. | HCOOH | B. | CCl4 | C. | COCl2 | D. | CH2ClCOOH |
 随着对合成氨研究的发展,希腊科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如图).钯电极A是电解池的阴极(填“阳”或“阴”),该极上的电极反应式是N2+6e-+6H+═2NH3.
随着对合成氨研究的发展,希腊科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如图).钯电极A是电解池的阴极(填“阳”或“阴”),该极上的电极反应式是N2+6e-+6H+═2NH3.