题目内容
11.常温下,在由水电离产生的H+浓度为1×10?13mol/L 的溶液中,一定能大量共存的离子组是( )| A. | K+、Cl-、NO3-、Fe2+ | B. | K+、Mg2+、I-、SO42- | ||
| C. | K+、Ca2+、Cl-、HCO3- | D. | Na+、Cl-、NO3-、S042- |
分析 由水电离出的c(H+)=1×10-13 mol•L-1的溶液,为酸或碱溶液,根据离子之间不能结合生成水、气体、沉淀等,不能发生氧化还原反应,则离子能大量共存,以此来解答.
解答 解:由水电离出的c(H+)=1×10-13 mol•L-1的溶液,为酸或碱溶液,
A.酸溶液中Fe2+、NO3-发生氧化还原反应,碱溶液中不能大量存在Fe2+,不能大量共存,故A错误;
B.碱溶液中不能大量存在Mg2+,故B错误;
C.无论酸性还是碱性,HCO3-都不能大量共存,故C错误;
D.无论酸或碱溶液中,该组离子之间均不反应,可大量共存,故D正确.
故选D.
点评 本题考查离子的共存,把握离子之间的反应即可解答,为高考常见题型,侧重复分解反应的考查,注意选项A中的氧化还原反应为解答的难点,题目难度不大.

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案
相关题目
19.有关下列流程的判断正确的是( )
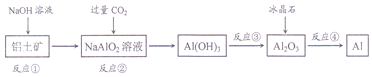

| A. | 流程中涉及的反应均为非氧化还原反应 | |
| B. | 反应②产生的阴离子主要为CO32- | |
| C. | 反应③在实验室中应在蒸发皿中进行 | |
| D. | 反应④的条件是对熔融状态下的反应物进行电解 |
6.下列有关化学用语表示正确的是( )
| A. | CO2的电子式: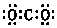 | B. | 中子数为21的钾原子:${\;}_{19}^{40}$K | ||
| C. | 甲烷分子的球棍模型: | D. | 氯离子的结构示意图: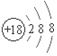 |
16.下列有关有机化合物的说法正确的是( )
| A. | CH2=CHCH3分子中所有原子在一个平面上 | |
| B. | 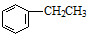 的同分异构体中,苯环上的一氯代物只有一种的结构有4种 的同分异构体中,苯环上的一氯代物只有一种的结构有4种 | |
| C. | CH2=CHCH2OH能发生加成发应、取代反应、氧化反应等 | |
| D. | 苯乙烯(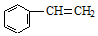 )能使溴水褪色,1mol苯乙烯与溴水反应时最多消耗4mol Br2 )能使溴水褪色,1mol苯乙烯与溴水反应时最多消耗4mol Br2 |
3.短周期主族元素X、Y、Z、W原子序数依次增大,X原子最外层比内层多3个电子,Y、W同主族且W的质子数是Y的两倍,Z在短周期元素中金属性最强.下列说法正确的是( )
| A. | X的简单气态氢化物的热稳定性比Y的强 | |
| B. | W的氧化物的水化物的酸性一定比X的强 | |
| C. | 半径r(W)>r(Z)>r(Y)>r(X) | |
| D. | Z与Y形成的两种常见化合物中,阴、阳离子个数比均为1:2 |
1.下列说法正确的是( )
| A. | 将NaH溶于水,得到的水溶液能导电说明NaH是离子化合物 | |
| B. | Fe(OH)3胶体和Fe(OH)3沉淀的化学性质不相同 | |
| C. | 乙醇分子中含羟基,可与金属钠反应生成氢气 | |
| D. | MnO2具有较强氧化性,可作为H2 O2分解反应的氧化剂 |