题目内容
15.下列各元素的原子半径最大的是( )| A. | F | B. | N | C. | O | D. | H |
分析 同周期自左而右原子半径减小,电子层越多原子半径越大,据此分析.
解答 解:N、O、F同周期,同周期自左而右原子半径减小,故原子半径:N>O>F,H只有1个电子层,半径最小,故原子半径N>O>F>H,
故选B.
点评 本题考查原子半径比较,比较基础,注意理解掌握微粒半径比较规律,注意周期表中原子半径最小的是H原子.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.一位同学在复习时遇到这样一道习题:某无色溶液中可能含有“H+、OH-、Na+、NO3-”,加入铝粉后,只产生H2,问该无色溶液中能大量存在哪几种离子.
(1)加入铝粉产生H2,说明铝具有还原性(填“氧化性”或“还原性”).
(2)该同学分析:若H+大量存在,则NO3-就不能大量存在.
设计实验证实如下:
①盐酸溶解Al2O3薄膜的离子方程式是6H++Al2O3=2Al3++3H2O.
②根据现象ⅱ,推测溶液中产生了NO,为进一步确认,进行如下实验:
a.浅棕色气体是NO2.
b.实验1的目的是对比实验,排除氧气使湿润的淀粉KI试纸变蓝的可能.
c.实验1、2说明反应生成了NO,将生成NO的离子方程式补充完整:
1Al+1NO3-+4H+═1Al3++1NO↑+2H2O.
(3)再假设:若OH-大量存在,NO3-也可能不能大量存在.
重新设计实验证实如下:
为确认“刺激性气味”气体,进行如下实验:用湿润KI-淀粉试纸检验,未变蓝;用湿润红色石蕊试纸检验,试纸变蓝.
①刺激性气味的气体是NH3.
②产生该气体的离子方程式是8Al+3NO3-+5OH-+2H2O=3NH3↑+8AlO2-.
(4)在NaOH溶液中加入铝粉,结果只检验出有H2生成,其化学方程式是2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
(5)实验结果证实:NO3?在酸、碱性环境中都有一定的氧化性,能氧化铝单质,产生含氮化合物.习题中的无色溶液一定能大量存在的是Na+和OH-.
(1)加入铝粉产生H2,说明铝具有还原性(填“氧化性”或“还原性”).
(2)该同学分析:若H+大量存在,则NO3-就不能大量存在.
设计实验证实如下:
| 装置 | 现象 |
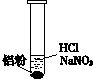 | ⅰ.实验初始,未见明显现象 ⅱ.过一会儿,出现气泡,液面上方呈浅棕色 ⅲ.试管变热,溶液沸腾 |
②根据现象ⅱ,推测溶液中产生了NO,为进一步确认,进行如下实验:
| 实 验 | 内 容 | 现 象 |
| 实验1 | 将湿润KI-淀粉试纸置于空气中 | 未变蓝 |
| 实验2 | 用湿润KI-淀粉试纸检验浅棕色气体 | 试纸变蓝 |
b.实验1的目的是对比实验,排除氧气使湿润的淀粉KI试纸变蓝的可能.
c.实验1、2说明反应生成了NO,将生成NO的离子方程式补充完整:
1Al+1NO3-+4H+═1Al3++1NO↑+2H2O.
(3)再假设:若OH-大量存在,NO3-也可能不能大量存在.
重新设计实验证实如下:
| 装置 | 现象 |
 | ⅰ.实验初始,未见明显现象 ⅱ.过一会儿,出现气泡,有刺激性气味 |
①刺激性气味的气体是NH3.
②产生该气体的离子方程式是8Al+3NO3-+5OH-+2H2O=3NH3↑+8AlO2-.
(4)在NaOH溶液中加入铝粉,结果只检验出有H2生成,其化学方程式是2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
(5)实验结果证实:NO3?在酸、碱性环境中都有一定的氧化性,能氧化铝单质,产生含氮化合物.习题中的无色溶液一定能大量存在的是Na+和OH-.
6.对于反应3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)的平衡常数K1,下列表述一定正确的是( )
| A. | K1=$\frac{[{H}_{2}]^{4}}{[{H}_{2}O]^{4}}$ | |
| B. | 增大c(H2O)或减小c(H2),会使平衡常数K1减小 | |
| C. | 改变反应的温度,平衡常数K1不一定变化 | |
| D. | Fe3O4(s)+4H2(g)?3Fe(s)+4H2O(g)的平衡常数为K2,K1×K2=1 |
10.已知mg硫酸铁中含有a个Fe3+,则阿伏加德罗常数可以表示为( )
| A. | $\frac{200a}{m}$mol-1 | B. | $\frac{200m}{a}$mol-1 | C. | $\frac{2m}{a}$mol-1 | D. | $\frac{2a}{m}$mol-1 |
7.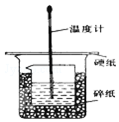 某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
(1)本实验中还缺少一个仪器,其名称是环形玻璃搅拌棒.在大小烧杯中填充泡沫塑料的作用是温隔热,防止热量散失.
(2)该实验小组做了三次实验,每次取溶液各50mL,并记录下原始数据(见表).
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混合液的比热容为:c=4.18×10-3kJ/(g•℃),则写出该反应的热化学方程式(离子方程式)H+(aq)+OH-(aq)=H2O(l)△H=-56.0kJ/mol (△H值保留到小数点后1位).
(3)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会比(2)测出的△H偏大(填“偏大”、“偏小”或“不变”).
(4)在中和热测定实验中存在用水洗涤温度计上的盐酸后再用温度计测定NaOH溶液温度的步骤,若无此
操作步骤,则测得的中和热△H会偏大(填“偏大”、“偏小”或“不变”).
 某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:(1)本实验中还缺少一个仪器,其名称是环形玻璃搅拌棒.在大小烧杯中填充泡沫塑料的作用是温隔热,防止热量散失.
(2)该实验小组做了三次实验,每次取溶液各50mL,并记录下原始数据(见表).
| 实验序号 | 起始温州 t1/℃ | 终止温度(t2)/℃[ | 温差 (t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
(3)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会比(2)测出的△H偏大(填“偏大”、“偏小”或“不变”).
(4)在中和热测定实验中存在用水洗涤温度计上的盐酸后再用温度计测定NaOH溶液温度的步骤,若无此
操作步骤,则测得的中和热△H会偏大(填“偏大”、“偏小”或“不变”).
4.a L含有硫酸铵和硝酸铵的混合溶液中,加入bmol NaOH并加热,恰好把NH3全部赶出;又加入cmol BaCl2沉淀反应恰好完全,则原溶液中NO3-的浓度为( )mol/L.
| A. | $\frac{b}{a}$ | B. | $\frac{c}{a}$ | C. | $\frac{b-2c}{a}$ | D. | $\frac{b-c}{a}$ |
5.(1)下列每组分别给出了两个量.其中可以组成一个物质的量公式的组有 (填编号)①④⑤
(2)在标准状况下:①6.72LCH4,②3.01×1023个HCl分子,③13.6gH2S,④0.2molNH3
下列对这四种气体的描述正确的是(填写代号)ABCD
A.质量②>③>①>④B.密度②>③>④>①C体积②>③>①>④D.氢原子数①>③>④>②
| ① | ② | ③ | ④ | ⑤ |
| 物质所含的微粒数 | 固体体积 | 溶液的质量百分比浓度 | 标准状况下气体的摩尔体积 | 非标准状况下某物质的质量 |
| 阿伏加德罗常数 | 固体密度 | 溶液体积 | 标准状况下气体的体积 | 物质的摩尔质量 |
下列对这四种气体的描述正确的是(填写代号)ABCD
A.质量②>③>①>④B.密度②>③>④>①C体积②>③>①>④D.氢原子数①>③>④>②
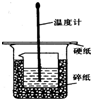 50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程 中放出的热量可计算中和热.回答下列问题:
50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程 中放出的热量可计算中和热.回答下列问题: