题目内容
A、B、C、D、E五种元素都位于短周期内,它们的原子序数依次递增.A原子的最外层电子数与次外层电子数一样,B原子的最外层电子数是内层电子数的2倍,C原子的核外电子数是D原子核外电子数的一半,D原子L层上电子数是M层电子数的2倍,E原子的M层电子数是K层电子数的3倍.由此推知:
(1)A是 B是 C是 D是 E是 (填元素符号)
(2)B单质在加热条件下能与C的最高价氧化物对应水化物浓溶液反应,方程式为:
(3)D单质在周期表中介于金属元素与非金属元素之间,可作为 (填导体、半导体或绝缘体)材料.其氧化物可与强碱NaOH反应,写出相关的离子方程式:
(4)D、E两种元素对应的气态氢化物稳定性大小比较: > ,最高价氧化物对应水化物酸性强弱: > (填化学式)
(5)已知A的氧化物性质与Al2O3相似,依据方程式:Al2O3+2NaOH═2NaAlO2+H2O,写出A的氧化物与NaOH反应的化学方程式 .
(1)A是
(2)B单质在加热条件下能与C的最高价氧化物对应水化物浓溶液反应,方程式为:
(3)D单质在周期表中介于金属元素与非金属元素之间,可作为
(4)D、E两种元素对应的气态氢化物稳定性大小比较:
(5)已知A的氧化物性质与Al2O3相似,依据方程式:Al2O3+2NaOH═2NaAlO2+H2O,写出A的氧化物与NaOH反应的化学方程式
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A原子的最外层电子数与次外层电子数一样,则A为Be;B原子的最外层电子数是内层电子数的2倍,应为C;D原子L层上电子数是M层电子数的2倍,则D为Si;C原子的核外电子数是D原子核外电子数的一半,则C为N;E原子的M层电子数是K层电子数的3倍,则E为S,结合题目要求可解答该题.
解答:
解:A原子的最外层电子数与次外层电子数一样,则A为Be;B原子的最外层电子数是内层电子数的2倍,应为C;D原子L层上电子数是M层电子数的2倍,则D为Si;C原子的核外电子数是D原子核外电子数的一半,则C为N;E原子的M层电子数是K层电子数的3倍,
(1)由题意可知A是Be、B是C、C是N、D是Si、E是S,故答案为:Be;C;N;Si;S;
(2)C在加热条件下与浓硝酸反应生成二氧化碳、二氧化氮和水,方程式为C+4HNO3 (浓)
CO2↑+4NO2↑+2H2O,
故答案为:C+4HNO3 (浓)
CO2↑+4NO2↑+2H2O;
(3)Si在周期表中介于金属元素与非金属元素之间,可常用为半导体;二氧化硅溶于NaOH生成硅酸钠和水,离子方程式为SiO2+2OH-=SiO32-+H2O,
故答案为:半导体;SiO2+2OH-=SiO32-+H2O.
(4)S的非金属性大于Si的非金属性,气态氢化物稳定性H2S>SiH4;最高价氧化物对应水化物酸性强弱:H2SO4>H2SiO3;
故答案为:H2S;SiH4;H2SO4;H2SiO3;
(5)类似方程式:Al2O3+2NaOH═2NaAlO2+H2O,BeO与NaOH反应的化学方程式为BeO+2NaOH=Na2BeO2+H2O,
故答案为:BeO+2NaOH=Na2BeO2+H2O.
(1)由题意可知A是Be、B是C、C是N、D是Si、E是S,故答案为:Be;C;N;Si;S;
(2)C在加热条件下与浓硝酸反应生成二氧化碳、二氧化氮和水,方程式为C+4HNO3 (浓)
| ||
故答案为:C+4HNO3 (浓)
| ||
(3)Si在周期表中介于金属元素与非金属元素之间,可常用为半导体;二氧化硅溶于NaOH生成硅酸钠和水,离子方程式为SiO2+2OH-=SiO32-+H2O,
故答案为:半导体;SiO2+2OH-=SiO32-+H2O.
(4)S的非金属性大于Si的非金属性,气态氢化物稳定性H2S>SiH4;最高价氧化物对应水化物酸性强弱:H2SO4>H2SiO3;
故答案为:H2S;SiH4;H2SO4;H2SiO3;
(5)类似方程式:Al2O3+2NaOH═2NaAlO2+H2O,BeO与NaOH反应的化学方程式为BeO+2NaOH=Na2BeO2+H2O,
故答案为:BeO+2NaOH=Na2BeO2+H2O.
点评:本题在考查元素的推断及有关知识,推出具体的元素是解题的关键,本题难度中等.

练习册系列答案
相关题目
依曲替酯是一种皮肤病用药,它可以由原料X经过多步反应合成.下列说法不正确的是( )
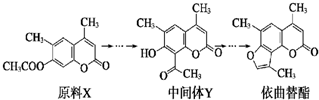

| A、原料X与中间体Y互为同分异构体 |
| B、原料X可以使酸性KMnO4溶液褪色 |
| C、中间体Y能发生加成、取代、消去反应 |
| D、1 mol依曲替酯只能与1 mol NaOH发生反应 |
已知Cu(NO3)2受热分解的化学方程式为2Cu(NO3)2═2CuO+4NO2↑+O2↑,将少量Cu(NO3)2固体放入试管中加热,然后用带火星的木条放入试管中,木条复燃,下列说法正确的是( )
| A、NO2能支持燃烧 |
| B、NO2不能支持燃烧 |
| C、木条复燃是因为硝酸铜分解产生了氧气的缘故 |
| D、木条复燃是因为硝酸铜分解产生了氧气和二氧化氮共同作用的结果 |
a mol 和b mol CH2=CH-CN加聚形成高聚物A,A在适量氧气中恰好完全燃烧,生成CO2、H2O(气)、N2.在相同条件下它们的体积比为12:8:1,则a:b为( )
和b mol CH2=CH-CN加聚形成高聚物A,A在适量氧气中恰好完全燃烧,生成CO2、H2O(气)、N2.在相同条件下它们的体积比为12:8:1,则a:b为( )
 和b mol CH2=CH-CN加聚形成高聚物A,A在适量氧气中恰好完全燃烧,生成CO2、H2O(气)、N2.在相同条件下它们的体积比为12:8:1,则a:b为( )
和b mol CH2=CH-CN加聚形成高聚物A,A在适量氧气中恰好完全燃烧,生成CO2、H2O(气)、N2.在相同条件下它们的体积比为12:8:1,则a:b为( )| A、1:1 | B、1:2 |
| C、2:3 | D、3:2 |
下列说法正确的是( )
| A、将少量的CO2气体通入足量次氯酸钠溶液中的离子方程式为:ClO+CO2+H2O═HCO3-+HClO,可得出电离平衡常数K1(H2CO3)>K(HClO)>K2(H2CO3) |
| B、已知Ag2CrO4的Ksp为1.12×10-12,则将等体积的1.0×10-3 mol?L-1的AgNO3溶液和1.0×10-3 mol?L-1的K2CrO4溶液混合,不会有沉淀生成 |
| C、相同物质的量浓度的下列溶液:①NH4HS O4 ②NH4Cl ③NH3?H2O,水电离程度由大到小的顺序是:①>②>③ |
| D、在0.1mol?L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+c(H2CO3) |
 已知化合物B3N3H6(硼氮苯)与C6H6(苯)的分子结构相似,如图所示,则硼氮苯的二氯取代物的同分异构体的数目为 ( )
已知化合物B3N3H6(硼氮苯)与C6H6(苯)的分子结构相似,如图所示,则硼氮苯的二氯取代物的同分异构体的数目为 ( )