题目内容
短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中C元素是地壳中含量最多的金属元素.

填写下列空白:
(1)写出D的氧化物的一种用途 .
(2)常温下,A的最高价氧化物对应水化物的浓溶液可用C单质制成的容器盛放,原因是 ,但NaOH溶液能溶解C的单质,有关的离子方程式为 .
(3)A、B两种元素的气态氢化物结合质子的能力由大到小的顺序为 (填化学式),用一个离子方程式证明 .
(4)常温下,A的某种氧化物为红棕色气体,lmol该气体与水完全反应放出46kJ热量,写出该反应的热化学方程式 .
(5)A的气态氢化物为甲,甲遇浓盐酸产生白烟,用电子式表示白烟的化学组成 .常温下,向V L pH=a的甲的水溶液中加入V L pH=b的盐酸,且a+b=14,则反应后溶液的pH 7(填“>”、“<”或“无法确定”),所得溶液中各种离子的浓度由大到小的顺序是 .

填写下列空白:
(1)写出D的氧化物的一种用途
(2)常温下,A的最高价氧化物对应水化物的浓溶液可用C单质制成的容器盛放,原因是
(3)A、B两种元素的气态氢化物结合质子的能力由大到小的顺序为
(4)常温下,A的某种氧化物为红棕色气体,lmol该气体与水完全反应放出46kJ热量,写出该反应的热化学方程式
(5)A的气态氢化物为甲,甲遇浓盐酸产生白烟,用电子式表示白烟的化学组成
考点:位置结构性质的相互关系应用,元素周期表的结构及其应用,元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:C元素是地壳中含量最多的金属元素,则C为Al,由短周期元素A、B、C、D在元素周期表中的相对位置可知,D为Si,A为N,B为O,
(1)D的氧化物为二氧化硅;
(2)常温下,A的最高价氧化物对应水化物的浓溶液为浓硝酸,遇Al发生钝化;Al与NaOH溶液反应生成偏铝酸钠和氢气;
(3)非金属性越强,气态氢化物越稳定,结合质子的能力越弱,如氨气与氢离子结合生成铵根离子;
(4)A的某种氧化物为红棕色气体,为二氧化氮,与水反应生成硝酸和NO;
(5)A的气态氢化物为甲,甲遇浓盐酸产生白烟,白烟为氯化铵,为离子化合物;在常温下,向VL pH=a的氨水溶液中c(OH-)=10 a-14 mol/L,VL pH=b的盐酸溶液中c(H+)=10-b mol/L,且a+b=14,所以c(OH-)=c(H+)=10-b mol/L=10 a-14 mol/L<c(NH3.H2O),二者反应,氨水过量,溶液显碱性,以此来解答.
(1)D的氧化物为二氧化硅;
(2)常温下,A的最高价氧化物对应水化物的浓溶液为浓硝酸,遇Al发生钝化;Al与NaOH溶液反应生成偏铝酸钠和氢气;
(3)非金属性越强,气态氢化物越稳定,结合质子的能力越弱,如氨气与氢离子结合生成铵根离子;
(4)A的某种氧化物为红棕色气体,为二氧化氮,与水反应生成硝酸和NO;
(5)A的气态氢化物为甲,甲遇浓盐酸产生白烟,白烟为氯化铵,为离子化合物;在常温下,向VL pH=a的氨水溶液中c(OH-)=10 a-14 mol/L,VL pH=b的盐酸溶液中c(H+)=10-b mol/L,且a+b=14,所以c(OH-)=c(H+)=10-b mol/L=10 a-14 mol/L<c(NH3.H2O),二者反应,氨水过量,溶液显碱性,以此来解答.
解答:
解:C元素是地壳中含量最多的金属元素,则C为Al,由短周期元素A、B、C、D在元素周期表中的相对位置可知,D为Si,A为N,B为O,
(1)D的氧化物为二氧化硅,可用于制备单晶硅、玻璃、光导纤维、建筑材料等,故答案为:制备单晶硅、玻璃、光导纤维、建筑材料等;
(2)常温下,A的最高价氧化物对应水化物的浓溶液为浓硝酸,遇Al发生钝化,生成致密的氧化膜阻止反应的进一步发生;Al与NaOH溶液反应生成偏铝酸钠和氢气,离子反应为2Al+2H2O+2OH-=2AlO2-+3H2↑,
故答案为:生成致密的氧化膜阻止反应的进一步发生;2Al+2H2O+2OH-=2AlO2-+3H2↑;
(3)非金属性越强,气态氢化物越稳定,结合质子的能力越弱,则结合质子的能力由大到小的顺序为NH3>H2O,如NH3+H3O+=NH4++H2O可证明,
故答案为:NH3>H2O;NH3+H3O+=NH4++H2O;
(4)A的某种氧化物为红棕色气体,为二氧化氮,与水反应生成硝酸和NO,lmol该气体与水完全反应放出46kJ热量,则3mol气体反应放出46kJ×3=138kJ,则热化学方程式为3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)△H=-138kJ/mol,故答案为:3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)△H=-138kJ/mol;
(5)A的气态氢化物为甲,甲遇浓盐酸产生白烟,白烟为氯化铵,为离子化合物,其电子式为 ;在常温下,向VL pH=a的氨水溶液中c(OH-)=10 a-14 mol/L,VL pH=b的盐酸溶液中c(H+)=10-b mol/L,且a+b=14,所以c(OH-)=c(H+)=10-b mol/L=10 a-14 mol/L<c(NH3.H2O),二者反应,氨水过量,溶液显碱性,pH>7,c(H+)<c(OH-) 且电荷守恒可知,则c(NH4+)>c( Cl-),故溶液中离子浓度大小顺序为c(NH4+)>c( Cl-)>c(OH-)>c(H+),故答案为:
;在常温下,向VL pH=a的氨水溶液中c(OH-)=10 a-14 mol/L,VL pH=b的盐酸溶液中c(H+)=10-b mol/L,且a+b=14,所以c(OH-)=c(H+)=10-b mol/L=10 a-14 mol/L<c(NH3.H2O),二者反应,氨水过量,溶液显碱性,pH>7,c(H+)<c(OH-) 且电荷守恒可知,则c(NH4+)>c( Cl-),故溶液中离子浓度大小顺序为c(NH4+)>c( Cl-)>c(OH-)>c(H+),故答案为: ;>;c(NH4+)>c( Cl-)>c(OH-)>c(H+).
;>;c(NH4+)>c( Cl-)>c(OH-)>c(H+).
(1)D的氧化物为二氧化硅,可用于制备单晶硅、玻璃、光导纤维、建筑材料等,故答案为:制备单晶硅、玻璃、光导纤维、建筑材料等;
(2)常温下,A的最高价氧化物对应水化物的浓溶液为浓硝酸,遇Al发生钝化,生成致密的氧化膜阻止反应的进一步发生;Al与NaOH溶液反应生成偏铝酸钠和氢气,离子反应为2Al+2H2O+2OH-=2AlO2-+3H2↑,
故答案为:生成致密的氧化膜阻止反应的进一步发生;2Al+2H2O+2OH-=2AlO2-+3H2↑;
(3)非金属性越强,气态氢化物越稳定,结合质子的能力越弱,则结合质子的能力由大到小的顺序为NH3>H2O,如NH3+H3O+=NH4++H2O可证明,
故答案为:NH3>H2O;NH3+H3O+=NH4++H2O;
(4)A的某种氧化物为红棕色气体,为二氧化氮,与水反应生成硝酸和NO,lmol该气体与水完全反应放出46kJ热量,则3mol气体反应放出46kJ×3=138kJ,则热化学方程式为3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)△H=-138kJ/mol,故答案为:3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)△H=-138kJ/mol;
(5)A的气态氢化物为甲,甲遇浓盐酸产生白烟,白烟为氯化铵,为离子化合物,其电子式为
 ;在常温下,向VL pH=a的氨水溶液中c(OH-)=10 a-14 mol/L,VL pH=b的盐酸溶液中c(H+)=10-b mol/L,且a+b=14,所以c(OH-)=c(H+)=10-b mol/L=10 a-14 mol/L<c(NH3.H2O),二者反应,氨水过量,溶液显碱性,pH>7,c(H+)<c(OH-) 且电荷守恒可知,则c(NH4+)>c( Cl-),故溶液中离子浓度大小顺序为c(NH4+)>c( Cl-)>c(OH-)>c(H+),故答案为:
;在常温下,向VL pH=a的氨水溶液中c(OH-)=10 a-14 mol/L,VL pH=b的盐酸溶液中c(H+)=10-b mol/L,且a+b=14,所以c(OH-)=c(H+)=10-b mol/L=10 a-14 mol/L<c(NH3.H2O),二者反应,氨水过量,溶液显碱性,pH>7,c(H+)<c(OH-) 且电荷守恒可知,则c(NH4+)>c( Cl-),故溶液中离子浓度大小顺序为c(NH4+)>c( Cl-)>c(OH-)>c(H+),故答案为: ;>;c(NH4+)>c( Cl-)>c(OH-)>c(H+).
;>;c(NH4+)>c( Cl-)>c(OH-)>c(H+).
点评:本题考查位置、结构性质的综合应用,为高频考点,把握元素的位置、元素的性质及化学反应原理为解答的关键,注重高频考点的考查,题目难度不大.

练习册系列答案
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
25℃时,弱酸的电离平衡常数如表所示,下列说法正确的是( )
| 弱酸 | CH3COOH | HCN | H2CO3 |
| Ka | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A、等物质的量浓度溶液pH关系:pH(CH3COONa)<pH(NaHCO3)<pH(NaCN) |
| B、a mol?L-1 HCN与b mol?L-1 NaOH溶液等体积混合后溶液中c(Na+)>c(CN-),则a一定小于b |
| C、0.1mol?L-1的CH3COOH的 pH比0.1mol?L-1 HCN的pH大 |
| D、NaHCO3和Na2CO3的混合液中:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
常温下,Na2CO3溶液中存在平衡:CO32-+H2O?HCO3-+OH-,下列有关该溶液的说法正确的是( )
| A、离子浓度:c(Na+)>c(CO32-)>c(OH-)>c(H+) |
| B、升高温度,平衡向右移动 |
| C、滴入CaCl2浓溶液,溶液的pH增大 |
| D、加入NaOH固体,溶液的pH减小 |
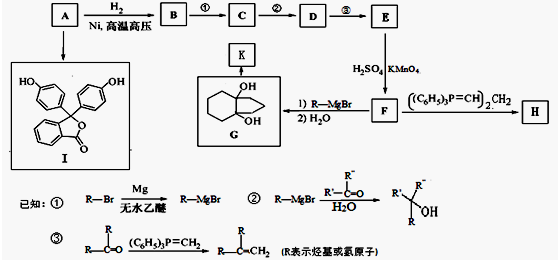
 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:

 已知A、B、C是三种常见的单质,其中A为固体,B、C为气体;D的饱和溶液滴入沸水中继续煮沸,溶液呈红褐色;B和C反应的产物极易溶于水得无色溶液E.它们之间转化关系如图所示.
已知A、B、C是三种常见的单质,其中A为固体,B、C为气体;D的饱和溶液滴入沸水中继续煮沸,溶液呈红褐色;B和C反应的产物极易溶于水得无色溶液E.它们之间转化关系如图所示.