题目内容
现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如图反应(图中有些反应产物和反应条件没有全部标出). 请根据信息回答下列问题:
(1)写出物质E的名称: ;说出黄绿色气体乙的一种用途 .
(2)实验室检验G中是否混有F的方法 .
(3)写出D溶液与金属B反应的离子方程式为 .
(4)反应⑤(物质F→物质G)的离子方程式为 .

(1)写出物质E的名称:
(2)实验室检验G中是否混有F的方法
(3)写出D溶液与金属B反应的离子方程式为
(4)反应⑤(物质F→物质G)的离子方程式为
考点:无机物的推断
专题:推断题
分析:金属A焰色反应为黄色,故A为金属Na,乙是黄绿色气体,乙为Cl2,红褐色沉淀H为Fe(OH)3;
由反应①Na→气体甲+D,为Na与水的反应,生成甲为H2,D为NaOH,由NaOH+金属B→H2可知,B为金属Al,由甲+乙→丙,故丙为HCl,HCl溶于水的物质E,故E为盐酸;
G+NaOH→Fe(OH)3,G含有Fe3+,由E(盐酸)
F
G可知,盐酸与金属C反应,生成的产物F还能继续与氯气反应,则金属C为变价金属,应为Fe,所以F为FeCl2,G为FeCl3,结合物质的性质解答该题.
由反应①Na→气体甲+D,为Na与水的反应,生成甲为H2,D为NaOH,由NaOH+金属B→H2可知,B为金属Al,由甲+乙→丙,故丙为HCl,HCl溶于水的物质E,故E为盐酸;
G+NaOH→Fe(OH)3,G含有Fe3+,由E(盐酸)
| 金属C |
| Cl2 |
解答:
解:金属A焰色反应为黄色,故A为金属Na,乙是黄绿色气体,乙为Cl2,红褐色沉淀H为Fe(OH)3;
由反应①Na→气体甲+D,为Na与水的反应,生成甲为H2,D为NaOH,由NaOH+金属B→H2可知,B为金属Al,由甲+乙→丙,故丙为HCl,HCl溶于水的物质E,故E为盐酸;
G+NaOH→Fe(OH)3,G含有Fe3+,由E(盐酸)
F
G可知,盐酸与金属C反应,生成的产物F还能继续与氯气反应,则金属C为变价金属,应为Fe,所以F为FeCl2,G为FeCl3,
(1)由以上分析可知E为盐酸,乙为氯气,可用于自来水消毒或制造盐酸,
故答案为:盐酸;自来水消毒或制造盐酸;
(2)F为FeCl2,可与酸性高锰酸钾发生氧化还原反应,如G中混有F,可用酸性高锰酸钾检验,可观察到高锰酸钾溶液褪色,
故答案为:取样,滴加高锰酸钾溶液看紫色是否消失;
(3)B为Al,D为NaOH,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4)反应⑤为FeCl2和Cl2的反应,方程式为2Fe2++Cl2═2Fe3++2Cl-,故答案为:2Fe2++Cl2═2Fe3++2Cl-.
由反应①Na→气体甲+D,为Na与水的反应,生成甲为H2,D为NaOH,由NaOH+金属B→H2可知,B为金属Al,由甲+乙→丙,故丙为HCl,HCl溶于水的物质E,故E为盐酸;
G+NaOH→Fe(OH)3,G含有Fe3+,由E(盐酸)
| 金属C |
| Cl2 |
(1)由以上分析可知E为盐酸,乙为氯气,可用于自来水消毒或制造盐酸,
故答案为:盐酸;自来水消毒或制造盐酸;
(2)F为FeCl2,可与酸性高锰酸钾发生氧化还原反应,如G中混有F,可用酸性高锰酸钾检验,可观察到高锰酸钾溶液褪色,
故答案为:取样,滴加高锰酸钾溶液看紫色是否消失;
(3)B为Al,D为NaOH,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4)反应⑤为FeCl2和Cl2的反应,方程式为2Fe2++Cl2═2Fe3++2Cl-,故答案为:2Fe2++Cl2═2Fe3++2Cl-.
点评:本题以无机框图题的形式考查Na、Al、Fe、Cl等元素单质及其化合物之间的相互转化关系、化学用语的书写、离子检验等,侧重于学生的分析能力和元素化合物知识的综合运用的考查,难度中等,注意把握物质之间转化的特点,尤其是物质反应的典型现象,注意基础知识的掌握.

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案
相关题目
依据物质的相关数据,可以推断物质的结构和性质.下列利用物质的相关数据作出的相应推断不合理的是( )
| A、依据元素的原子序数,推断该元素原子的核外电子数 |
| B、依据物质相对分子质量,推断物质熔、沸点的高低 |
| C、依据气体的摩尔质量,推断相同状态下不同气体密度的大小 |
| D、依据液体物质的沸点,推断将两种互溶液态混合物用蒸馏法分离的可行性 |
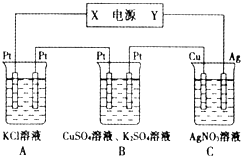 Na-Al/FeS是一种可充电电池,电池中用含Na+导电固体作为电解质,在工作过程中Na+的物质的量保持不变.
Na-Al/FeS是一种可充电电池,电池中用含Na+导电固体作为电解质,在工作过程中Na+的物质的量保持不变.
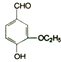 )是食品添加剂的增香原料,其香味比香草醛更加浓郁.
)是食品添加剂的增香原料,其香味比香草醛更加浓郁.

