题目内容
9.下列反应的离子方程式书写正确的是( )| A. | SiO2与NaOH溶液反应:SiO2+2Na++2OH-═Na2SiO3+H2O | |
| B. | 金属铝溶于氢氧化钠溶液:Al+2OH-═AlO2-+H2↑ | |
| C. | Fe2O3溶于盐酸:Fe2O3+6H+═2Fe3++3H2O | |
| D. | 铁与足量稀硝酸反应:Fe+4H++NO3-═Fe3++NO↑+2H2O |
分析 A.硅酸钠为易溶的强电解质,离子方程式中应该拆开;
B.2mol铝完全反应生成3mol氢气,该反应不满足电子守恒;
C.氧化铁与盐酸反应生成氯化铁和水;
D.铁与足量稀硝酸反应生成硝酸铁、NO气体和水.
解答 解:A.SiO2与NaOH溶液反应生成硅酸钠和水,正确的离子方程式为:SiO2+2OH-═SiO32-+H2O,故A错误;
B.金属铝溶于氢氧化钠溶液,反应生成偏铝酸钠和氢气,正确的离子方程式为:2Al+2H2O+2OH-═2AlO2-+3H2↑,故B错误;
C.Fe2O3溶于盐酸,反应的离子方程式为:Fe2O3+6H+═2Fe3++3H2O,故C正确;
D.铁与足量稀硝酸反应的离子方程式为:Fe+4H++NO3-═Fe3++NO↑+2H2O,故D正确;
故选CD.
点评 本题考查了离子方程式的正误判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
19.下列说法正确的是( )
| A. | 石油的分馏、裂化和煤的干馏都是化学变化 | |
| B. | 中国民间说的“硝石”是指KNO3,“硝强水”HNO3水溶液 | |
| C. | 乙烯、聚氯乙烯、苯乙烯分子结构中都含有不饱和键 | |
| D. | 分子式为C8H8O2分子结构中含有苯环且能够发生水解反应的同分异构体(不考虑立体异构)有5种 |
17.以葡萄糖为燃料的微生物燃料电池结构示意图如图所示,关于该电池的叙述正确的是( )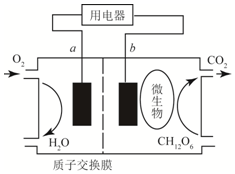

| A. | 该电池能够将电能转化为化学能 | |
| B. | b为该电池的正极 | |
| C. | 放电过程中,H+从a极区向b极区迁移 | |
| D. | 在电池反应中,正极上每消耗5.6L(标准状况下)气体时,则有NA个H通过质子交换膜 |
4.最近美国宇航局(NASA)马里诺娃博士找到了一种比二氧化碳有效104倍的“超级温室气体”--全氟丙烷(C3F8),并提出了其“温室化火星”使其成为第二个地球的计划.有关全氟丙烷的说法正确的确( )
| A. | 分子中三个碳原子可能处于同一直线上 | |
| B. | 全氟丙烷的电子式为  | |
| C. | 相同压强下,沸点:C3F8)<C5H8 | |
| D. | 全氟丙烷分子中既有极性键又有非极性键 |
1.下列反应的离子方程式书写正确的是( )
| A. | 实验室用大理石和稀盐酸抽取CO2:2H++CO32-═CO2↑+H2O | |
| B. | 氢氧化铝与盐酸反应:H++OH-═H2O | |
| C. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| D. | NO2与水的反应:3NO2+H2O═2NO3-+2H++NO |
13.已知常温下,电离常数大小排序有HF>HClO>HCN,现有浓度均为0.1mol•L-1的三种溶液:①NaF(aq)、②NaClO(aq)、③NaCN,下列说法正确的是( )
| A. | c(Na+):①>②>③ | B. | 水电离的c(OH-):③>②>① | ||
| C. | 离子总浓度:③>②>① | D. | pH:①>②>③ |