题目内容
X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息如下表:
(1)W位于元素周期表第 周期第 族,W的基态原子外围有 个不同运动状态的电子.
(2)X的电负性比Y的 (填“大”或“小”);Z的第一电离能比Y的 (填“大”或“小”).X和Y的气态氢化物中,较稳定的是 (写化学式).Y所在族各种元素的气态氢化物中沸点最低的是 (写化学式).
(3)写出M、Y形成的化合物与Z的最高价氧化物对应的水化物反应的化学方程式 .
(4)在500℃,30MPa下,将1molH2与足量的Z2置于密闭容器中充分反应生成ZH3,H2的转化率为25%时,放出热量为7.7kJ.写出该热化学反应方程式 .
| 元素 | 相关信息 |
| X | X的基态原子L层电子数是K层电子数的2倍 |
| Y | Y形成的多种单质,其中之一是地球生物的“保护伞” |
| Z | Z的基态原子核外p能级总电子数比s能级总电子数少一个 |
| M | M存在质量数为27,中子数为14的核素 |
| W | W有多种化合价,其白色氢氧化合物在空气中会迅速变成灰绿色,最后变成红褐色 |
(2)X的电负性比Y的
(3)写出M、Y形成的化合物与Z的最高价氧化物对应的水化物反应的化学方程式
(4)在500℃,30MPa下,将1molH2与足量的Z2置于密闭容器中充分反应生成ZH3,H2的转化率为25%时,放出热量为7.7kJ.写出该热化学反应方程式
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X、Y、Z、W是元素周期表前四周期中的常见元素,
X的基态原子L层电子数是K层电子数的2倍,则L层电子数为4,则X是C元素;
Y形成的多种单质,其中之一是地球生物的“保护伞”臭氧,则Y是O元素;
Z的基态原子核外p能级总电子数比s能级总电子数少一个,且为短周期元素,其s电子总数为4、p电子总数为3,则Z为N元素;
M存在质量数为27、中子数为14的核素,则M质子数为13,所以M为Al元素;
W有多种化合价,其白色氢氧化合物在空气中会迅速变成灰绿色,最后变成红褐色,则W为Fe元素,
(1)W为Fe元素,位于元素周期表第四周期第VIII族,基态原子核外有多少种能级就有多少种运动状态;
(2)元素的非金属性越强,其电负性越大,非金属性O;
同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;
元素的非金属性越强,其气态氢化物越稳定;同一主族元素的氢化物中,其氢化物沸点随着相对分子质量的增大而增大,但含有氢键的物质沸点最高;
(3)Al、O形成的化合物Al2O3与N的最高价氧化物对应的水化物HNO3反应生成盐和水;
(4)在500℃,30MPa下,将1molH2与足量的N2置于密闭容器中充分反应生成NH3,H2的转化率为25%时,氢气参加反应的物质的量=1mol×25%=0.25mol,放出热量为7.7kJ,3mol氢气完全反应放出的热量=
×3mol=92.4kJ.
X的基态原子L层电子数是K层电子数的2倍,则L层电子数为4,则X是C元素;
Y形成的多种单质,其中之一是地球生物的“保护伞”臭氧,则Y是O元素;
Z的基态原子核外p能级总电子数比s能级总电子数少一个,且为短周期元素,其s电子总数为4、p电子总数为3,则Z为N元素;
M存在质量数为27、中子数为14的核素,则M质子数为13,所以M为Al元素;
W有多种化合价,其白色氢氧化合物在空气中会迅速变成灰绿色,最后变成红褐色,则W为Fe元素,
(1)W为Fe元素,位于元素周期表第四周期第VIII族,基态原子核外有多少种能级就有多少种运动状态;
(2)元素的非金属性越强,其电负性越大,非金属性O;
同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;
元素的非金属性越强,其气态氢化物越稳定;同一主族元素的氢化物中,其氢化物沸点随着相对分子质量的增大而增大,但含有氢键的物质沸点最高;
(3)Al、O形成的化合物Al2O3与N的最高价氧化物对应的水化物HNO3反应生成盐和水;
(4)在500℃,30MPa下,将1molH2与足量的N2置于密闭容器中充分反应生成NH3,H2的转化率为25%时,氢气参加反应的物质的量=1mol×25%=0.25mol,放出热量为7.7kJ,3mol氢气完全反应放出的热量=
| 7.7kJ |
| 0.25mol |
解答:
解:X、Y、Z、W是元素周期表前四周期中的常见元素,
X的基态原子L层电子数是K层电子数的2倍,则L层电子数为4,则X是C元素;
Y形成的多种单质,其中之一是地球生物的“保护伞”臭氧,则Y是O元素;
Z的基态原子核外p能级总电子数比s能级总电子数少一个,且为短周期元素,其s电子总数为4、p电子总数为3,则Z为N元素;
M存在质量数为27、中子数为14的核素,则M质子数为13,所以M为Al元素;
W有多种化合价,其白色氢氧化合物在空气中会迅速变成灰绿色,最后变成红褐色,则W为Fe元素,
(1)W为Fe元素,位于元素周期表第四周期第VIII族,基态原子核外有多少种能级就有多少种运动状态,基态Fe原子核外有8种能级,所以其基态原子核外有8种运动状态,故答案为:四;VIII;8;
(2)元素的非金属性越强,其电负性越大,非金属性O>C,所以电负性O>C;
同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,Z是N元素、Y是O元素,二者位于同一周期,N元素位于第VA族、O元素位于第VIA族,所以第一电离能N>O;
元素的非金属性越强,其气态氢化物越稳定,非金属性O>C,所以气态氢化物稳定性O>C,所以氢化物较稳定的是 H2O;
同一主族元素的氢化物中,其氢化物沸点随着相对分子质量的增大而增大,但含有氢键的物质沸点最高,Y是O元素,氧族元素中,水的相对分子质量最小,但含有氢键导致其沸点最高,所以沸点最低的是H2S,
故答案为:小;大;H2O;H2S;
(3)Al、O形成的化合物Al2O3与N的最高价氧化物对应的水化物HNO3反应生成盐和水,反应方程式为Al2O3+6HNO3=2Al(NO3)3+3H2O,故答案为:Al2O3+6HNO3=2Al(NO3)3+3H2O;
(4)在500℃,30MPa下,将1molH2与足量的N2置于密闭容器中充分反应生成NH3,H2的转化率为25%时,氢气参加反应的物质的量=1mol×25%=0.25mol,放出热量为7.7kJ,3mol氢气完全反应放出的热量=
×3mol=92.4kJ,其热化学方程式为:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ?mol-1,故答案为:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ?mol-1.
X的基态原子L层电子数是K层电子数的2倍,则L层电子数为4,则X是C元素;
Y形成的多种单质,其中之一是地球生物的“保护伞”臭氧,则Y是O元素;
Z的基态原子核外p能级总电子数比s能级总电子数少一个,且为短周期元素,其s电子总数为4、p电子总数为3,则Z为N元素;
M存在质量数为27、中子数为14的核素,则M质子数为13,所以M为Al元素;
W有多种化合价,其白色氢氧化合物在空气中会迅速变成灰绿色,最后变成红褐色,则W为Fe元素,
(1)W为Fe元素,位于元素周期表第四周期第VIII族,基态原子核外有多少种能级就有多少种运动状态,基态Fe原子核外有8种能级,所以其基态原子核外有8种运动状态,故答案为:四;VIII;8;
(2)元素的非金属性越强,其电负性越大,非金属性O>C,所以电负性O>C;
同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,Z是N元素、Y是O元素,二者位于同一周期,N元素位于第VA族、O元素位于第VIA族,所以第一电离能N>O;
元素的非金属性越强,其气态氢化物越稳定,非金属性O>C,所以气态氢化物稳定性O>C,所以氢化物较稳定的是 H2O;
同一主族元素的氢化物中,其氢化物沸点随着相对分子质量的增大而增大,但含有氢键的物质沸点最高,Y是O元素,氧族元素中,水的相对分子质量最小,但含有氢键导致其沸点最高,所以沸点最低的是H2S,
故答案为:小;大;H2O;H2S;
(3)Al、O形成的化合物Al2O3与N的最高价氧化物对应的水化物HNO3反应生成盐和水,反应方程式为Al2O3+6HNO3=2Al(NO3)3+3H2O,故答案为:Al2O3+6HNO3=2Al(NO3)3+3H2O;
(4)在500℃,30MPa下,将1molH2与足量的N2置于密闭容器中充分反应生成NH3,H2的转化率为25%时,氢气参加反应的物质的量=1mol×25%=0.25mol,放出热量为7.7kJ,3mol氢气完全反应放出的热量=
| 7.7kJ |
| 0.25mol |
点评:本题考查位置结构性质的相互关系及应用,涉及热化学反应方程式、氢键、电负性和电离能等知识点,侧重考查学生综合应用能力,氢键只影响物质物理性质不影响化学性质,氢键属于分子间作用力,知道第一电离能变化规律及异常现象,题目难度中等.

练习册系列答案
相关题目
下列各组物质中,按酸、碱、盐的顺序排列正确的是( )
| A、氢硫酸、烧碱、明矾 |
| B、硫酸、纯碱、石膏 |
| C、硝酸、乙醇、醋酸钠 |
| D、磷酸、熟石灰、苛性钠 |
A、B、C短周期元素在周期表中的位置如图所示,已知A、C可分别与B形成化合物X和Y,A与B的质子数之和等于C的质子数,现有以下说法,判断正确的是( )
| A | B |
| C |
| A、B形成的单质存在同素异形体,C的单质不存在同素异形体 |
| B、C的最高价氧化物对应的水化物能与A的常见氢化物形成三种盐 |
| C、常温下,B的氢化物中无H+ |
| D、Y的种类比X多 |
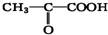 ),由以上事实推知乳酸的结构简式为
),由以上事实推知乳酸的结构简式为