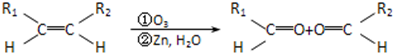
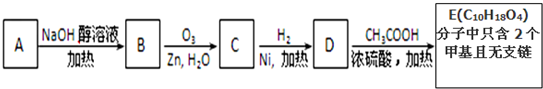
题目内容
已知X、Y、Z、W是短周期中四种非金属元素,它们的原子序数依次增大.X元素原子形成的离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍.
(1)写出元素符号:X ;Y ;Z ;W .
(2)X单质和Z单质在一定条件下反应生成化合物E,E分子的空间构成型为 ,分子的极性为 .
(3)这四种元素可组成原子个数比为5:1:1:3的化合物(按X、Y、Z、W的顺序),该化合物的化学式为 ,它含有的化学键类型有 键、 键和 键.
(1)写出元素符号:X
(2)X单质和Z单质在一定条件下反应生成化合物E,E分子的空间构成型为
(3)这四种元素可组成原子个数比为5:1:1:3的化合物(按X、Y、Z、W的顺序),该化合物的化学式为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:(1)X、Y、Z、W是短周期中四种非金属元素,它们的原子序数依次增大,X元素原子形成的离子就是一个质子,则X是H元素,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,且Z原子序数小于W,则Z是N元素、W是O元素,Y原子的最外层电子数是内层电子数的2倍,最外层电子数不超过8个,K层为内层,则Y为C元素;
(2)H2和N2在一定条件下反应生成化合物E,E为NH3,根据价层电子对互斥理论确定分子空间构型;分子中正负电荷重心不重合的分子为极性分子,否则为非极性分子;
(3)这四种元素可组成原子个数比为5:1:1:3的化合物(按X、Y、Z、W的顺序),该化合物的化学式为NH4HCO3,该化合物属于离子化合物,铵根离子中存在配位键,非金属元素之间易形成共价键.
(2)H2和N2在一定条件下反应生成化合物E,E为NH3,根据价层电子对互斥理论确定分子空间构型;分子中正负电荷重心不重合的分子为极性分子,否则为非极性分子;
(3)这四种元素可组成原子个数比为5:1:1:3的化合物(按X、Y、Z、W的顺序),该化合物的化学式为NH4HCO3,该化合物属于离子化合物,铵根离子中存在配位键,非金属元素之间易形成共价键.
解答:
解:X、Y、Z、W是短周期中四种非金属元素,它们的原子序数依次增大,X元素原子形成的离子就是一个质子,则X是H元素,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,且Z原子序数小于W,则Z是N元素、W是O元素,Y原子的最外层电子数是内层电子数的2倍,最外层电子数不超过8个,K层为内层,则Y为C元素,
(1)通过以上分析知,X、Y、Z、W分别是H、C、N、O,故答案为:H;C;N;O;
(2)H2和N2在一定条件下反应生成化合物E,E为NH3,氨气分子中N原子价层电子对个数是4且含有一个孤电子对,所以氨气分子的空间构成型为三角锥形,该分子中正负电荷重心不重合,所以该分子的极性为极性分子,
故答案为:三角锥形;极性分子;
(3)这四种元素可组成原子个数比为5:1:1:3的化合物(按X、Y、Z、W的顺序),该化合物的化学式为NH4HCO3,该化合物属于离子化合物,铵根离子和碳酸氢根离子之间存在离子键、铵根离子中N原子和H原子之间存在配位键和共价键,碳酸氢根离子中C原子和O原子之间存在共价键,所以该物质中含有离子键、共价键和配位键,故答案为:NH4HCO3;离子;共价;配位键.
(1)通过以上分析知,X、Y、Z、W分别是H、C、N、O,故答案为:H;C;N;O;
(2)H2和N2在一定条件下反应生成化合物E,E为NH3,氨气分子中N原子价层电子对个数是4且含有一个孤电子对,所以氨气分子的空间构成型为三角锥形,该分子中正负电荷重心不重合,所以该分子的极性为极性分子,
故答案为:三角锥形;极性分子;
(3)这四种元素可组成原子个数比为5:1:1:3的化合物(按X、Y、Z、W的顺序),该化合物的化学式为NH4HCO3,该化合物属于离子化合物,铵根离子和碳酸氢根离子之间存在离子键、铵根离子中N原子和H原子之间存在配位键和共价键,碳酸氢根离子中C原子和O原子之间存在共价键,所以该物质中含有离子键、共价键和配位键,故答案为:NH4HCO3;离子;共价;配位键.
点评:本题考查位置结构性质的相互关系及应用,涉及分子构型判断、分子极性判断、化学键判断等知识点,会根据价层电子对互斥理论判断分子空间构型,注意配位键属于共价键,不属于独立的化学键,题目难度不大.

练习册系列答案
相关题目
已知1-18号元素的离子aW3+、bX+、CY2-、dZ-都具有相同的电子层结构,则下列叙述或表示方法正确的是( )
| A、四种元素位于同一周期 |
| B、氢化物的稳定性H2Y>HZ |
| C、离子的氧化性aW3+>bX+ |
| D、原子半径Z>Y |
在指定环境中,下列各组离子一定可以大量共存的是( )
| A、使甲基橙变红的溶液中:Cr2O72-、Fe2+、SO42-、K+ |
| B、无色强酸性溶液中:Na+、Cl-、SO42-、[Cu(NH3)4]2+ |
| C、加入过量氨水溶液仍然澄清的溶液中:Cu2+、Ag+、NO3-、NH4+ |
| D、能使碘化钾淀粉试纸变蓝的溶液中:Na+、NH4+、S2-、Br- |
铝不易被腐蚀,其主要原因是( )
| A、铝是一种轻金属 |
| B、铝的金属活动性比镁弱 |
| C、铝具有较高熔点 |
| D、铝易形成致密的氧化物薄膜 |
 实验室用MnO2与浓HCl反应制Cl2,若用如图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属镁粉的反应.每个虚线框表示一个单元装置,其中错误的是( )
实验室用MnO2与浓HCl反应制Cl2,若用如图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属镁粉的反应.每个虚线框表示一个单元装置,其中错误的是( )| A、只有①和②处 |
| B、只有②处 |
| C、只有①、②和③处 |
| D、①、②、③、④处 |
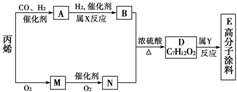 有一种广泛用于汽车、家电产品上的高分子涂料,是按下列流程生产的.图中M(C3H4O)和A均能发生银镜反应.N和M的分子中碳原子数相同,A的烃基上的一氯取代位置有三种.
有一种广泛用于汽车、家电产品上的高分子涂料,是按下列流程生产的.图中M(C3H4O)和A均能发生银镜反应.N和M的分子中碳原子数相同,A的烃基上的一氯取代位置有三种.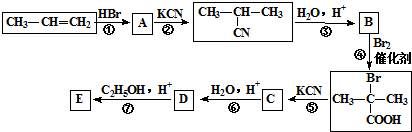
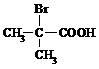 与足量NaOH溶液反应的化学方程式为
与足量NaOH溶液反应的化学方程式为