题目内容
4.将0.5L 2mol/L盐酸与足量AgNO3溶液充分反应.试计算:(1)生成AgCl的物质的量为多少?
(2)生成HNO3的质量为多少?
分析 n(HCl)=2mol/L×0.5L=1mol,
(1)HCl与足量的硝酸银溶液反应生成AgCl沉淀和硝酸,根据Cl原子守恒计算n(AgCl);
(2)HCl与足量的硝酸银溶液反应生成AgCl沉淀和硝酸,根据H原子守恒计算n(HNO3),再根据m=nM计算硝酸的质量.
解答 解:n(HCl)=2mol/L×0.5L=1mol,
(1)HCl与足量的硝酸银溶液反应生成AgCl沉淀和硝酸,根据Cl原子守恒得n(AgCl)=n(HCl)=1mol,
答:生成硝酸银的物质的量是1mol;
(2)HCl与足量的硝酸银溶液反应生成AgCl沉淀和硝酸,根据H原子守恒得n(HNO3)=n(HCl)=1mol,m(HNO3)=nM=1mol×63g/mol=63g,
答:生成硝酸的质量是63g.
点评 本题考查化学方程式的有关计算,为高频考点,明确各个物理量之间的关系式是解本题关键,把握原则守恒即可解答,题目难度不大.

练习册系列答案
相关题目
3.15.6g Na2O2放入水中充分反应将产生的气体与铜和铁的混合物11.2g恰好完全反应,将所得氧化铜、氧化铁用足量CO还原,理论上最少需标准状况下CO的体积为( )
| A. | 1.12L | B. | 2.24L | C. | 3.36L | D. | 4.48L |
12.下列有关气体摩尔体积的描述中正确的是( )
| A. | 气体摩尔体积的数值是固定不变的,都约为22.4L | |
| B. | 通常情况的气体摩尔体积约为22.4L | |
| C. | 标准状况下的气体的摩尔体积约为22.4L | |
| D. | 标准状况下,气体的摩尔体积约为22.4L/mol |
19.分子式为C5H10O2,属于酯类的同分异构体有多少种( )
| A. | 9种 | B. | 13种 | C. | 10种 | D. | 11种 |
16.下列溶液中NO3-的物质的量浓度最大的是( )
| A. | 500 mL 1 mol•L-1的KNO3溶液 | |
| B. | 500 mL 1 mol•L-1的Ba(NO3)2溶液 | |
| C. | 1000 mL 0.5 mol•L-1的Mg(NO3)2溶液 | |
| D. | 1000 mL 0.5 mol•L-1的Fe(NO3)3溶液 |
13.下列说法正确的是( )
| A. | 绿色食品就是指颜色为绿色的食品 | B. | 有机食品是指含有机物的食品 | ||
| C. | OTC表示处方药 | D. | 加碘盐是在食盐中加入KIO3 |
14. (1)已知:在常温下,浓度均为0.1mol•L-1的下列六种溶液的pH:
(1)已知:在常温下,浓度均为0.1mol•L-1的下列六种溶液的pH:
复分解反应存在这样一个规律:一种较强酸(或碱性较强的物质)可以自发地反应生成较弱酸(或碱性较弱的物质).照该规律,请判断下列反应不能成立的是CD (填编号).
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO D.CO2+H2O+2C6H5ONa=Na2CO3+2C6H5OH
(2)根据前述信息判断,浓度均为0.05mol•L-1的下列六种物质的溶液中,pH最小的是⑤ (填编号);将各溶液分别稀释100倍,pH变化最小的是① (填编号).
①C6H5OH ②CH3COOH ③HCN ④HClO ⑤H2SO4 ⑥HClO4
(3)根据前述信息,写出将过量的氯气通入到少量的碳酸钠溶液中反应的离子方程式:Cl2+H2O+2CO32-=2HCO3-+Cl-+ClO-.
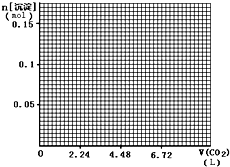
(4)标准状况下,向1L含NaOH、Ca(OH)2各0.1mol的溶液中不断通入CO2至过量,请画出产生的沉淀的物质的量(mol)随CO2通入体积(L)的变化趋势图.
 (1)已知:在常温下,浓度均为0.1mol•L-1的下列六种溶液的pH:
(1)已知:在常温下,浓度均为0.1mol•L-1的下列六种溶液的pH:| 溶质 | CH3CO ONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO D.CO2+H2O+2C6H5ONa=Na2CO3+2C6H5OH
(2)根据前述信息判断,浓度均为0.05mol•L-1的下列六种物质的溶液中,pH最小的是⑤ (填编号);将各溶液分别稀释100倍,pH变化最小的是① (填编号).
①C6H5OH ②CH3COOH ③HCN ④HClO ⑤H2SO4 ⑥HClO4
(3)根据前述信息,写出将过量的氯气通入到少量的碳酸钠溶液中反应的离子方程式:Cl2+H2O+2CO32-=2HCO3-+Cl-+ClO-.
(4)标准状况下,向1L含NaOH、Ca(OH)2各0.1mol的溶液中不断通入CO2至过量,请画出产生的沉淀的物质的量(mol)随CO2通入体积(L)的变化趋势图.
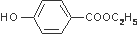 ,其生产过程如图所示(反应条件未全部注明):
,其生产过程如图所示(反应条件未全部注明):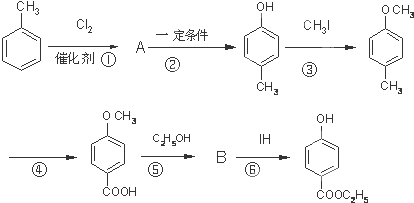
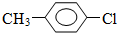 .
. +CH3I→
+CH3I→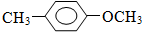 +HI
+HI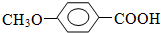 $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$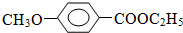 C2H5OH+H2O
C2H5OH+H2O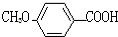 的同分异构体有多种,其中既含有酚羟基,又含有醇羟基和醛基的同分异构体共有13种,写出其中一种结构简式
的同分异构体有多种,其中既含有酚羟基,又含有醇羟基和醛基的同分异构体共有13种,写出其中一种结构简式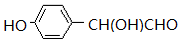 .
.