题目内容
下列离子方程式中不正确的是( )
| A、铁片放入氯化铁溶液中:Fe+Fe3+═2Fe2+ |
| B、二氧化碳通入碳酸钠溶液中:CO2+CO32-+H2O═2HCO3- |
| C、硫酸铝溶液跟氨水反应:Al3++3NH3?H2O═Al(OH)3↓+3 NH4+ |
| D、氯气通入冷的氢氧化钠溶液中:Cl2+2OH-═Cl-+ClO-+H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A、根据电荷守恒判断,离子方程式两边电荷不相等;
B、碳酸根离子与二氧化碳反应生成了碳酸氢根离子;
C、一水合氨为弱碱,不能够溶解氢氧化铝,铝离子与氨水反应生成了氢氧化铝沉淀;
D、氯气与氢氧化钠溶液反应生成了氯化钠、次氯酸钠和水.
B、碳酸根离子与二氧化碳反应生成了碳酸氢根离子;
C、一水合氨为弱碱,不能够溶解氢氧化铝,铝离子与氨水反应生成了氢氧化铝沉淀;
D、氯气与氢氧化钠溶液反应生成了氯化钠、次氯酸钠和水.
解答:
解:A、铁与铁离子反应生成了亚铁离子,方程式两边电荷必须守恒,正确的离子方程式为:Fe+2Fe3+═3Fe2+,故A错误;
B、二氧化碳通入碳酸钠溶液中,反应生成了碳酸氢根离子,反应的离子方程式为:CO2+CO32-+H2O═2HCO3-,故B正确;
C、氢氧化铝不溶于弱碱,硫酸铝与氨水反应生成氢氧化铝沉淀,反应的离子方程式为:Al3++3NH3?H2O═Al(OH)3↓+3NH4+,故C正确;
D、氯气通入冷的氢氧化钠溶液中,反应生成了氯化钠、次氯酸钠和水,反应的离子方程式为:Cl2+2OH-═Cl-+ClO-+H2O,故D正确;
故选A.
B、二氧化碳通入碳酸钠溶液中,反应生成了碳酸氢根离子,反应的离子方程式为:CO2+CO32-+H2O═2HCO3-,故B正确;
C、氢氧化铝不溶于弱碱,硫酸铝与氨水反应生成氢氧化铝沉淀,反应的离子方程式为:Al3++3NH3?H2O═Al(OH)3↓+3NH4+,故C正确;
D、氯气通入冷的氢氧化钠溶液中,反应生成了氯化钠、次氯酸钠和水,反应的离子方程式为:Cl2+2OH-═Cl-+ClO-+H2O,故D正确;
故选A.
点评:本题考查了离子方程式的正误判断,题目难度中等,该题是高考中的高频题,侧重对学生能力的培养和训练,该题有助于培养学生分析问题、解决问题的能力;判断离子方程式正确与否的方法一般为:(1)检查反应能否发生(2)检查反应物、生成物是否正确(3)检查各物质拆分是否正确(4)检查是否符合守恒关系(如:质量守恒和电荷守恒等).

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目
下列离子方程式正确的是( )
| A、NaHS溶液水解的方程式为:HS-+H2O?S2-+H3O+ | ||||
| B、向H218O中投入Na2O2固体:2H218O+2Na2O2═4Na++4OH-+18O2↑ | ||||
| C、在100 mL 2 mol/L FeBr2溶液中通入4.48 L氯气(标况下),充分反应:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | ||||
D、用惰性电极电解饱和氯化钠溶液:2Cl-+2H+
|
下列说法正确的是( )
| A、二氧化硅溶于水显酸性 |
| B、光导纤维传导光的能力非常强,利用光缆通讯,能同时传送大量信息 |
| C、因为高温时二氧化硅与碳酸钠反应放出CO2,所以硅酸的酸性比碳酸强 |
| D、二氧化硅是酸性氧化物,它不溶于任何酸 |
在标准状况下,一个容器充满O2重66.4g,充满N2重66g,则该气容器的容积为( )
| A、5.6L | B、11.2L |
| C、2.24L | D、4.48L |


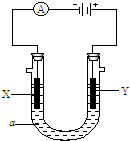 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: )与苯炔(
)与苯炔( )反应生成如图所示化合物X(立体对称图形),
)反应生成如图所示化合物X(立体对称图形),

 b. C6H14 c.
b. C6H14 c. d.
d.