题目内容
13. 一种具有很高比能量的新型干电池的工作原理如图所示:放电时的电极反应式之一为MnO2+e-+H2O═MnO(OH)+OH-,下列说法正确的是( )
一种具有很高比能量的新型干电池的工作原理如图所示:放电时的电极反应式之一为MnO2+e-+H2O═MnO(OH)+OH-,下列说法正确的是( )| A. | 铝电极上的电极反应式:Al-3e-+3NH3•H20═Al(OH)3+3NH4+ | |
| B. | 电池工作时,NH4+、Na+移向铝电极 | |
| C. | 每消耗27g铝就会有3mol电子通过溶液转移到正极上 | |
| D. | 放电过程中正极附近溶液的PH减小 |
分析 放电时的电极反应式之一为MnO2+e-+H2O═MnO(OH)+OH-,MnO2得电子为正极,则Al为负极,失电子,在氨水溶液中Al失电子生成Al(OH)3沉淀,原电池中阳离子向正极移动,电子从负极流向正极,但是电子不能通过溶液,结合电极方程式判断溶液的pH变化.
解答 解:A.MnO2得电子为正极,则Al为负极,失电子,在氨水溶液中Al失电子生成Al(OH)3沉淀,则负极电极方程式为Al-3e-+3NH3•H20═Al(OH)3+3NH4+,故A正确;
B.原电池工作时,阳离子向正极移动,即NH4+、Na+移向MnO2电极,故B错误;
C.电子从负极流向正极,但是电子只能在导线和电极上移动,不能通过溶液,故C错误;
D.正极的电极反应式为MnO2+e-+H2O═MnO(OH)+OH-,所以放电过程中正极附近溶液的PH增大,故D错误.
故选A.
点评 本题考查原电池的组成和工作原理,题目难度中等,注意把握电极的组成和电极反应式的书写,侧重于考查学生对基础知识的应用能力.

练习册系列答案
相关题目
18.下列说法正确的是( )
| A. | 0.1mol/L醋酸溶液加水稀释,电离平衡正移,电离平衡常数增大 | |
| B. | 0.1mol/L醋酸溶液中加入锌粒,电离平衡正移,c(H+)增大 | |
| C. | 0.1mol/L醋酸钠溶液中加入醋酸钠固体,水解平衡正移,c(OH-)增大 | |
| D. | 在AgCl饱和溶液中加入AgCl固体,沉淀溶解平衡正移,c(Ag+)增大 |
19.下列对于浓硝酸、浓硫酸的说法,不正确的是( )
| A. | 浓硝酸在见光或受热时会发生分解 | |
| B. | 金属与硝酸反应不产生氢气 | |
| C. | 可用铁和铝制品盛装浓硝酸、浓硫酸 | |
| D. | 往浓硫酸与铜反应后的试管中加水稀释,溶液呈蓝色,说明生成了Cu2+ |
1.X、Y、Z均为元素周期表中的前20号元素,可形成化合物XYZ4,三种元素的最外层电子数之和为14,且均不在同一周期和同一主族.下列有关推断不正确的是( )
| A. | 若X 化合价为+2价,则Y的化合价为+6价 | |
| B. | 若XYZ4是一种可溶性的盐,则XY也是一种可溶性的盐 | |
| C. | 若XYZ4是一种强酸,则XY 也是一种强酸 | |
| D. | XYZ4可能是共价化合物,也可能是离子化合物 |
8.五联苯 的一氯代物有( )
的一氯代物有( )
 的一氯代物有( )
的一氯代物有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
18.下列各组物质中,互为同分异构体的是( )
| A. | ${\;}_{3}^{6}$Li和${\;}_{3}^{7}$Li | B. | CH3-CH2-CH2-CH3和CH3-CH(CH3)-CH3 | ||
| C. | O2和O3 | D. | CH4和CH3-CH3 |
5.下列有机物存在顺反异构的是( )
| A. | CH2=CH2 | B. | CH2=CHCH2CH3 | C. | CH3CH=CHCH3 | D. | CH3CH2OH |
2.下列对有机化合物性质的叙述错误的是( )
| A. | 乙烯和苯都能使溴水褪色,均与溴水发生加成反应 | |
| B. | 淀粉、油脂、蛋白质都能水解,但水解产物不同 | |
| C. | 二氯甲烷只有一种说明甲烷分子是以碳原子为中心的正四面体结构 | |
| D. | 乙醇、乙酸、乙酸乙酯都能发生取代反应 |
3.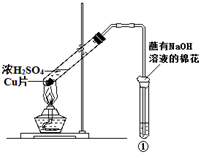 用如图所示装置进行实验,如表对实验现象及解释都正确的是( )
用如图所示装置进行实验,如表对实验现象及解释都正确的是( )
 用如图所示装置进行实验,如表对实验现象及解释都正确的是( )
用如图所示装置进行实验,如表对实验现象及解释都正确的是( )| ①中试剂 | ①中现象 | 解释 | |
| A | BaCl2溶液 | 生成白色沉淀 | SO32-与Ba2+生成白色BaSO3沉淀 |
| B | 滴加了酚酞的氢氧化钠溶液 | 溶液褪色 | SO2具有漂白性 |
| C | 紫色石蕊溶液 | 溶液变红 | SO2与水反应生成酸 |
| D | 硫化氢溶液 | 溶液变浑浊 | SO2具有还原性 |
| A. | A | B. | B | C. | C | D. | D |