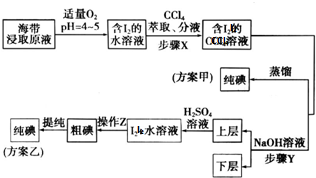
题目内容
18.下列说法正确的是( )| A. | 0.1mol/L醋酸溶液加水稀释,电离平衡正移,电离平衡常数增大 | |
| B. | 0.1mol/L醋酸溶液中加入锌粒,电离平衡正移,c(H+)增大 | |
| C. | 0.1mol/L醋酸钠溶液中加入醋酸钠固体,水解平衡正移,c(OH-)增大 | |
| D. | 在AgCl饱和溶液中加入AgCl固体,沉淀溶解平衡正移,c(Ag+)增大 |
分析 A.醋酸是弱电解质存在电离平衡,加水稀释促进电离,电离平衡常数只随温度变化;
B.醋酸是弱电解质存在电离平衡,醋酸溶液中加入锌和溶液中氢离子反应生成氢气;
C.醋酸钠溶液中醋酸根离子水解,加入醋酸钠,醋酸根离子浓度增大平衡正向进行;
D.在AgCl饱和溶液中加入AgCl固体不能继续溶解,存在沉淀溶解平衡不发生变化;
解答 解:A.0.1mol/L醋酸溶液加水稀释,电离平衡正移,电离平衡常数不变,故A错误;
B..1mol/L醋酸溶液中加入锌粒,和氢离子反应生成氢气,电离平衡正移,c(H+)减小,故B错误;
C.0.1mol/L醋酸钠溶液中加入醋酸钠固体溶解后醋酸根离子浓度增大,CH3COO-+H2O?CH3COOH+OH-,水解平衡正移,c(OH-)增大,故C正确;
D.在AgCl饱和溶液中加入AgCl固体,沉淀溶解平衡不变,c(Ag+)不变,故D错误;
故选C.
点评 本题考查了弱电解质电离平衡、盐类水解平衡的影响因素分析、注意平衡常数随温度变化,不随浓度变化,题目难度中等.

练习册系列答案
相关题目
8.某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
试根据上表中的实验现象回答下列问题:
(1)实验1、2中Al所作的电极是否相同?不同.
(2)实验1、4中Al所作的电极是否相同?不同.
(3)写出实验3中的电极反应式.正极:2H++2e-═H2↑;
(4)用电子式表示氯化镁的形成过程: .
.
| 编号 | 电极材料 | 电解质溶液 | 电流指针偏转方向 |
| 1 | Mg Al | 稀盐酸 | 偏向Al |
| 2 | Al Cu | 稀盐酸 | 偏向Cu |
| 3 | Al 石墨 | 稀盐酸 | 偏向石墨 |
| 4 | Mg Al | NaOH溶液 | 偏向Mg |
| 5 | Al Zn | 浓硝酸 | 偏向Al |
(1)实验1、2中Al所作的电极是否相同?不同.
(2)实验1、4中Al所作的电极是否相同?不同.
(3)写出实验3中的电极反应式.正极:2H++2e-═H2↑;
(4)用电子式表示氯化镁的形成过程:
 .
.
9.下列曲线图的描述正确的是( )
| A. | 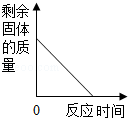 加热一定量高锰酸钾固体制取氧气 | |
| B. | 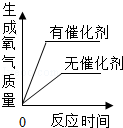 用一定量的双氧水制取氧气 | |
| C. | 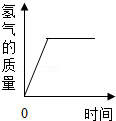 一定质量的锌粒与足量稀盐酸反应 | |
| D. | 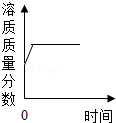 在恒温条件下往硝酸钾饱和溶液中继续加入硝酸钾固体 |
6.下列设备工作时,将化学能转化为电能的是( )
| A. | 锂离子电池 | B. | 太阳能热水器 | C. | 天然气燃气灶 | D. | 硅太阳能电池 |
13.下列有机物的表达式不正确的是( )
| A. | 乙烯(C2H4)的电子式: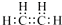 | B. | 丙烯(C3H6)的结构简式:CH2CHCH3 | ||
| C. | 立方烷(C8H8)的键线式: | D. | 溴乙烷(C2H5Br)的比例模型: |
3.海洋约占地球表面的71%,具有十分巨大的开发潜力,目前的南海争端威胁到我们国家的核心利益.通过海水资源的开发利用不能得到的是( )
| A. | 重水 | B. | 淡水 | C. | 石油、天然气 | D. | 钠、钾、镁、溴 |
7.常温下,向0.1mol•L-1CH3COOH溶液中不断加水,过程中始终保持增大的是( )
| A. | c(H+) | B. | Ka(CH3COOH) | C. | c(H+)•c(OH-) | D. | $\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ |
13. 一种具有很高比能量的新型干电池的工作原理如图所示:放电时的电极反应式之一为MnO2+e-+H2O═MnO(OH)+OH-,下列说法正确的是( )
一种具有很高比能量的新型干电池的工作原理如图所示:放电时的电极反应式之一为MnO2+e-+H2O═MnO(OH)+OH-,下列说法正确的是( )
 一种具有很高比能量的新型干电池的工作原理如图所示:放电时的电极反应式之一为MnO2+e-+H2O═MnO(OH)+OH-,下列说法正确的是( )
一种具有很高比能量的新型干电池的工作原理如图所示:放电时的电极反应式之一为MnO2+e-+H2O═MnO(OH)+OH-,下列说法正确的是( )| A. | 铝电极上的电极反应式:Al-3e-+3NH3•H20═Al(OH)3+3NH4+ | |
| B. | 电池工作时,NH4+、Na+移向铝电极 | |
| C. | 每消耗27g铝就会有3mol电子通过溶液转移到正极上 | |
| D. | 放电过程中正极附近溶液的PH减小 |