题目内容
碱性锌锰电池是一种常见的一次电池,应用非常广泛,其工作时发生如下反应:Zn+2MnO2+H2O=2MnOOH+Zn(OH)2,则( )
| A、Zn为负极,MnO2为正极 |
| B、MnO2为正极,Zn为负极 |
| C、工作时电子由MnO2经外电路流向Zn极 |
| D、Zn电极发生还原反应,MnO2电极发生氧化反应 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:由方程式可知Zn元素化合价升高,被氧化,应为原电池的负极,Mn元素化合价降低,被还原,为原电池的正极,原电池工作时,电子由负极经外电路流向正极,以此解答该题.
解答:
解:A.Zn元素化合价升高,被氧化,应为负极,Mn元素化合价降低,被还原,MnO2为正极,故A正确;
B.由A分析可知Zn为负极,MnO2为正极,故B错误;
C.Zn为负极,MnO2为正极,电子由Zn经外电路流向MnO2极,故C错误;
D.由化合价变化可知,Zn电极发生氧化反应,MnO2电极发生含有反应,故D错误.
故选A.
B.由A分析可知Zn为负极,MnO2为正极,故B错误;
C.Zn为负极,MnO2为正极,电子由Zn经外电路流向MnO2极,故C错误;
D.由化合价变化可知,Zn电极发生氧化反应,MnO2电极发生含有反应,故D错误.
故选A.
点评:本题考查原电池知识,为高考高频考点,侧重于学生的分析能力的考查,注意把握原电池的工作原理,难度不大,注相关基础知识的积累.

练习册系列答案
相关题目
下列关于实验操作能实现目的是( )
A、 分离碘酒中的碘和酒精 |
B、 实验室制氨气 |
C、 除去Cl2中的HCl |
D、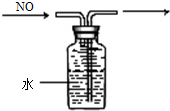 排水集气法收集NO |
设NA为阿伏加德罗常数.下列叙述不正确的是( )
| A、标准状况下,2.24L Cl2完全溶于足量的水中,转移电子的数目为0.1NA |
| B、常温常压下,11.0g C3H8中含有共价键的数目为2.5NA |
| C、常温常压下,1L 0.1mol?L-1 NH4NO3溶液中NO3-的数目为0.1NA |
| D、30g甲醛(HCHO)和醋酸的混合物中含碳原子数目为NA |
下列叙述正确的是( )
| A、单体的质量之和就是所生成高聚物的质量 |
| B、单体是一种物质时发生加聚反应 |
| C、缩聚反应的单体只有一种 |
| D、淀粉和纤维素因聚合度不同所以他们不是同分异构体 |
下列说法不正确的是( )
| A、分子式为C5H10O2的羧酸共有3种 |
| B、分子式为C3H9N的异构体共有4个 |
| C、某烷烃CnH2n+2的一个分子中,含有共价键的数目是3n+1 |
| D、某烷烃CnH2n+2的一个分子中,含有非极性键的数目是n-1 |
下列离子方程式正确的是( )
| A、澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+═Ca2++2H2O |
| B、稀硫酸与氢氧化钡溶液混合:H++SO42-+Ba2++OH-=H2O+BaSO4↓ |
| C、铜片插入硝酸银溶液中 Cu+Ag+═Cu2++Ag |
| D、氧化铁与稀盐酸混合:Fe2O3+6H+=2Fe3++3H2O |
常温下pH=3的二元弱酸H2R溶液与a L pH=11的NaOH溶液混合后,混合液的pH刚好等于7(假设反应前后体积不变),则对反应后混合液的叙述正确的是( )
| A、c(R2-)+c(OH-)=c(Na+)+c(H+) |
| B、c(R2-)>c(Na+)>c(H+)=c(OH-) |
| C、2c(R2-)+c(HR-)=c(Na+) |
| D、混合后溶液的体积为2a L |
 某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题: