题目内容
12.由于金属锌本身的价值不高,在我国工业锌废料的回收利用率比较低,某课题组研究利用含少量铜、铁的粗锌制备硫酸锌及相关物质的资源综合利用,其工艺流程图(图中加入的物质均为足量)及有关数据如下:请回答下列问题:
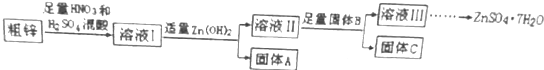
| 物质 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS |
| Ksp | 4.0×10-38 | 5.0×10-20 | 2.0×10-16 | 8.5×10-45 | 1.2×10-23 |
(2)粗锌中的铜与稀混酸溶液反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
(3)若溶液Ⅱ中c(Cu2+)为0.05mol•L-1,则溶液Ⅱ的pH≤5.
(4)若B是Zn,取8.320gC完全溶解于500mL1mol•L-1稀硝酸中,共收集到2240mL气体,再向所得溶液中加入NaOH溶液至刚好生成沉淀最多,此时所得沉淀质量(m)的取值范围是13.42;若B是另一种物质,取部分C于试管中,加入盐酸后产生了有臭鸡蛋味气体,则该反应的离子方程式为ZnS+2H+=H2S↑+Zn2+.
分析 利用含铜、铁的粗锌制备硫酸锌:粗铜中铜、铁和硫酸、硝酸反应,生成铜离子、铁离子,根据Ksp可知,氢氧化铜比氢氧化锌更难溶,向溶液中加入Zn(OH)2,得到沉淀A为Fe(OH)3,加入足量固体B,因B不同沉淀C成分不同,但滤液Ⅲ为硫酸锌溶液,制备七水合硫酸锌,防止结晶水失水,需冷却结晶,过滤、洗涤、干燥,即得到较纯净的硫酸锌晶体.
解答 解:利用含铜、铁的粗锌制备硫酸锌:粗铜中铜、铁和硫酸、硝酸反应,生成铜离子、铁离子,根据Ksp可知,氢氧化铜比氢氧化锌更难溶,向溶液中加入Zn(OH)2,得到沉淀A为Fe(OH)3,加入足量固体B,因B不同沉淀C成分不同,但滤液Ⅲ为硫酸锌溶液,制备七水合硫酸锌,防止结晶水失水,需冷却结晶,过滤、洗涤、干燥,即得到较纯净的硫酸锌晶体,
(1)由以上分析可知固体A的主要成分是Fe(OH)3,固体B可为氢氧化铜、氧化铜、硫化锌或锌等,用于除去溶液Ⅱ中的Cu2+,
故答案为:Fe(OH)3;除去溶液Ⅱ中的Cu2+;
(2)粗锌中的铜与稀混酸溶液反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(3)若溶液Ⅱ中c(Cu2+)为0.05mol•L-1,由Ksp=5.0×10-20可知,c(OH-)=$\sqrt{\frac{5.0×1{0}^{-20}}{0.05}}$mol/L=1.0×10-9mol/L,则c(H+)=1.0×10-5mol/L,
所以pH≤5,
故答案为:5;
(4)若B是Zn,则固体C为Zn和Cu的混合物,取8.320gC完全溶解于500mL1mol•L-1稀硝酸中,共收集到2240mL气体,即n(NO)=$\frac{2.24L}{22.4L/mol}$=0.1mol,转移0.3mol电子,由关系式Zn、Cu$\stackrel{2e-}{→}$Zn2+、Cu2+$\stackrel{2OH-}{→}$Cu(OH)2、Zn(OH)2可知,总质量为8.320g+0.3mol×17g/mol=13.42g,若固体B是另一种物质,取部分固体C于试管中,加入足量的盐酸,有臭鸡蛋气味的气体产生,气体为硫化氢,该实验为制备硫酸锌,则B应为ZnS,固体C中含有ZnS和CuS,和盐酸反应生成硫化氢的物质为硫化锌,反应为:ZnS+2H+=H2S↑+Zn2+,
故答案为:13.42;ZnS+2H+=H2S↑+Zn2+.
点评 本题考查了利用含铜、铁的粗锌制备硫酸锌,为高考常见题型,侧重于学生的分析、实验和计算能力的考查,涉及氮的化合物、沉淀溶解平衡应用、氧化还原等知识,理清沉淀溶解平衡的有关计算是解本题关键,题目难度中等.

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案| A. | 物质的是七个基本物理量之一 | B. | 阿伏加德罗常数是没有单位的 | ||
| C. | 1mol氮气的体积是22.4L | D. | 1mol H2O含有1个水分子 |
| A. | 18 | B. | 20 | C. | 16 | D. | 22 |
| 选项 | 操作 | 现象 | 结论 |
| A | 将乙醇和苯配成相同物质的量浓度的水溶液 | 加入大小相同的金属钠,观察反应快慢 | 两者的羟基活性不同 |
| B | 向Na2SiO3溶液中通入CO2气体 | 溶液变浑浊 | 碳的非金属性比硅强 |
| C | 将过量的铁粉和氯气反应,将反应后的固体溶于盐酸后,滴加KSCN溶液 | 溶液不显红色 | 过量铁与氯气反应产物为FeCl2 |
| D | 向Al(SO4)3溶液中滴入氨水至过量 | 溶液先变浑浊后又澄清 | Al(SO4)3溶液既有酸性又有碱性 |
| A. | A | B. | B | C. | C | D. | D |
| 化学方程式 | 平衡常数K | 化学方程式 | 平衡常数K |
| F2+H2?2HF | 6.5×1095 | Br2+H2?2HBr | 1.9×1019 |
| Cl2+H2?2HCl | 2.6×1033 | I2+H2?2HI | 8.7×102 |
| A. | X2与H2反应的反应速率依次减小 | B. | F2的转化率最大 | ||
| C. | X2与H2反应的剧烈程度逐渐减弱 | D. | 升高温度,平衡常数都增大 |
| A. | C生成的速率与C分解的速率相等 | |
| B. | 单位时间内消耗a mol A,同时生成3a mol C | |
| C. | 容器内的压强不再变化 | |
| D. | 混合气体中B物质的量不再变化 |
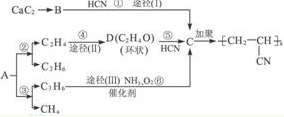 人造羊毛的主要成分为聚丙烯腈
人造羊毛的主要成分为聚丙烯腈 ,此物质可由以下三种途径合成,已知A是石油分馏的一种产品.
,此物质可由以下三种途径合成,已知A是石油分馏的一种产品.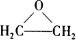 .
.