题目内容
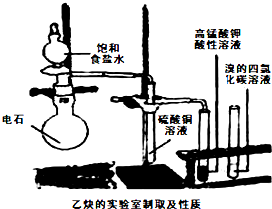
 某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴阳极,槽中盛放含铬废水,原理示意图如图,下列说法正确的是( )
某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴阳极,槽中盛放含铬废水,原理示意图如图,下列说法正确的是( )| A、A电源的负极 |
| B、阳极区溶液中发生的氧化还原反应为Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O |
| C、阴极区附近溶液的pH降低 |
| D、若不考虑气体的溶解,当收集到H213.44L时有0.1molCr2O72-被还原 |
考点:电解原理
专题:
分析:A.由图可知,右侧生成氢气,发生还原反应,右侧铁板为阴极,故左侧铁板为阳极;
B.左侧铁板为阳极,铁放电生成亚铁离子,亚铁离子被溶液中的Cr2O72-氧化,反应生成Cr3+、Fe3+;
C.阴极氢离子放电生成氢气,氢离子浓度降低;
D.根据n=
计算氢气的物质的量,根据电子转移计算n(Fe2+),根据方程式计算被还原的Cr2O72-的物质的量.
B.左侧铁板为阳极,铁放电生成亚铁离子,亚铁离子被溶液中的Cr2O72-氧化,反应生成Cr3+、Fe3+;
C.阴极氢离子放电生成氢气,氢离子浓度降低;
D.根据n=
| V |
| Vm |
解答:
解:A.由图可知,右侧生成氢气,发生还原反应,右侧铁板为阴极,故左侧铁板为阳极,故A为电源正极,故A错误;
B.左侧铁板为阳极,铁放电生成亚铁离子,亚铁离子被溶液中的Cr2O72-氧化,反应生成Cr3+、Fe3+,发应的离子方程式为Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,故B正确;
C.阴极氢离子放电生成氢气,氢离子浓度降低,溶液的pH增大,故C错误;
D.13.44 L氢气的物质的量为
=0.6mol,根据电子转移守恒n(Fe2+)=
=0.6mol,根据Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O可知,被还原的Cr2O72-的物质的量为0.6mol×
=0.1mol,故D正确;
故选BD.
B.左侧铁板为阳极,铁放电生成亚铁离子,亚铁离子被溶液中的Cr2O72-氧化,反应生成Cr3+、Fe3+,发应的离子方程式为Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,故B正确;
C.阴极氢离子放电生成氢气,氢离子浓度降低,溶液的pH增大,故C错误;
D.13.44 L氢气的物质的量为
| 13.44L |
| 22.4L/mol |
| 0.6mol×2 |
| 2 |
| 1 |
| 6 |
故选BD.
点评:本题以废水处理为载体考查电解原理、氧化还原反应、化学计算等,注意根据电解产物判断电极,题目难度中等.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
检验某未知溶液中是否含有SO42-,下列操作最合理的是( )
| A、先加稀硝酸酸化,再加入Ba(NO3)2溶液 |
| B、加BaCl2溶液即可 |
| C、先加盐酸酸化,再加BaCl2溶液 |
| D、加Ba(NO3)2溶液即可 |
室温下,0.1mol/L氨水10mL,加蒸馏水稀释到1L后,下列变化中正确的是 ①电离度增大 ②C(OH-)增大 ③C(H+]增大 ④KW 增大⑤导电性增强 ⑥
增大( )
| c(OH-) |
| c(NH3?H2O) |
| A、①②③ | B、①③⑤ |
| C、①③⑥ | D、②④⑥ |
人类的生活离不开材料,
①塑料广泛应用与生产、生活的各个领域,聚乙烯塑料属于 (填序号)
A.有机高分子材料 B.无机非金属材料 C.金属材料
②蚕丝、尼龙、棉花这三种常见的纤维中,主要成分为蛋白质的是 .
①塑料广泛应用与生产、生活的各个领域,聚乙烯塑料属于
A.有机高分子材料 B.无机非金属材料 C.金属材料
②蚕丝、尼龙、棉花这三种常见的纤维中,主要成分为蛋白质的是
下列各组物质的性质比较中不正确的是( )
| A、氧化性:F2>C12>Br2 |
| B、酸性:HClO4>H2SO4>H3PO4 |
| C、碱性:NaOH>Mg(OH)2>Al(OH)3 |
| D、热稳定性:SiH4>PH3>H2S |

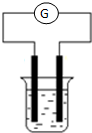 现有A、B、C、D和Cu五种金属片,将其分别用导线连接后浸入稀硫酸中(如图),每次实验时,通过灵敏电流计测出电子流动方向如下:
现有A、B、C、D和Cu五种金属片,将其分别用导线连接后浸入稀硫酸中(如图),每次实验时,通过灵敏电流计测出电子流动方向如下: