题目内容
2.已知一定条件下断裂1mol下列化学键生成气态原子需要吸收的能量如下:H-H 436kJ;Cl-Cl 243kJ;H-Cl 431kJ.下列所得热化学方程式或结论正确的是( )| A. | H(g)+Cl(g)═HCl(g)△H=-431kJ•mol-1 | |
| B. | 2HCl(g)═H2(g)+Cl2(g)的反应热△H<0 | |
| C. | H2(g)+Cl2(g)═2HCl(g)△H=-183kJ | |
| D. | 相同条件下,H2(g)+Cl2(g)═2HCl(g)反应在光照和点燃条件下的△H不相等 |
分析 A.根据断裂要吸收热量,形成则要放出热量;
B.根据正逆反应焓变符合相反判断;
C.热化学方程式反应热的单位为kJ/mol;
D.焓变与反应条件无关.
解答 解:A.因为断裂H-Cl要吸收431kJ,所以H(g)+Cl(g)=HCl(g)△H=-431 kJ•mol-1,故A正确;
B.H2(g)+Cl2(g)=2HCl(g),反应热△H=生成物的键能-反应物的键能=436kJ•mol-1+243kJ•mol-1-2×431 kJ•mol-1=-183kJ•mol-1,即△H=-183kJ/mol,所以2HCl(g)=H2(g)+Cl2(g)的反应热△H>0,故B错误;
C.H2(g)+Cl2(g)=2HCl(g)的反应热=反应物的总键能减生成物的总键能=436kJ•mol-1+243kJ•mol-1-2×431 kJ•mol-1=-183kJ•mol-1,热化学方程式H2(g)+Cl2(g)=2HCl(g)△H=-183kJ/mol,故C错误;
D.因为焓变与反应条件无关,所以H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H相等,故D错误;
故选A.
点评 本题主要考查了反应热的计算,难度不大,注意掌握热化学方程式的书写,明确反应热等于反应物的总键能-生成物的总键是关键.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目
10.氮是地球上含量丰富的一种元素,氮元素的单质及其化合物在工农业生产、生活中有着重要作用.

(1)根据右侧能量变化示意图1;请写出NO2和CO反应的热化学方程式NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ•mol-1.
(2)在固定体积的密闭容器中,进行如下化学反应3A(s)+4B(g)?4C(g)△H>0
其平衡常数K与温度T的关系如下表:
①该反应的平衡常数表达式:K=$\frac{{c}^{4}(C)}{{c}^{4}(B)}$.
②试判断K1<K2(填写“>”,“=”或“<”).
③下列各项能说明该反应已达到平衡状态韵是bd (填字母).
a.容器内B.C的浓度之比为1:1
b.v(B)正=v(C)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(3)对反应N2O4(g)?2NO2(g)△H>0,在温度
分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图2所示,下列说法正确的是cd.
a.A、C两点的反应速率:A>C b.A、C两点的化学平衡常数:A>C
c.A、C两点N2O4的转化率:A>C d.由状态B到状态A,可以用加热的方法
(4)一定温度下,在l L密闭容器中充入1molN2和3molH2并发生反应.若容器容积恒定,10min达到平衡时,气体的总物质的量为原来的$\frac{7}{8}$,则N2的转化率a(N2)=25%,以NH3表示该过程的反应速率v(NH3)=0.05mol/L•min.

(1)根据右侧能量变化示意图1;请写出NO2和CO反应的热化学方程式NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ•mol-1.
(2)在固定体积的密闭容器中,进行如下化学反应3A(s)+4B(g)?4C(g)△H>0
其平衡常数K与温度T的关系如下表:
| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
②试判断K1<K2(填写“>”,“=”或“<”).
③下列各项能说明该反应已达到平衡状态韵是bd (填字母).
a.容器内B.C的浓度之比为1:1
b.v(B)正=v(C)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(3)对反应N2O4(g)?2NO2(g)△H>0,在温度
分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图2所示,下列说法正确的是cd.
a.A、C两点的反应速率:A>C b.A、C两点的化学平衡常数:A>C
c.A、C两点N2O4的转化率:A>C d.由状态B到状态A,可以用加热的方法
(4)一定温度下,在l L密闭容器中充入1molN2和3molH2并发生反应.若容器容积恒定,10min达到平衡时,气体的总物质的量为原来的$\frac{7}{8}$,则N2的转化率a(N2)=25%,以NH3表示该过程的反应速率v(NH3)=0.05mol/L•min.
7.恒温恒压下,一个容积可变的密闭容器中发生反应:A(g)+B(g)═C(g).若开始时通入1molA和1molB,则达到平衡时生成a molC.则下列说法错误的是( )
| A. | 若开始时通入3molA和3molB,则达到平衡时,生成C的物质的量为3amol | |
| B. | 若开始时通入4molA和4molB、2molC,则达到平衡时,生成B的物质的量一定大于4mol | |
| C. | 若开始时通入2molA和2molB、1molC,则达到平衡时,在通入3molC,则再次达到平衡后,C的体积分数为$\frac{a}{2-a}$ | |
| D. | 若在原平衡体系中,在通入1molA和1molB,则混合气体的平均相对分子质量不变 |
14.某矿物X由Al2O3、Fe2O3、Cu2O、SiO2中的一种或几种物质组成.现进行如图所示实验:
(已知:Cu2O+2H+═Cu+Cu2++H2O)( )

(已知:Cu2O+2H+═Cu+Cu2++H2O)( )
| A. | 步骤1中减少的固体一定是混合物 | |
| B. | 根据上述步骤可以判断矿物X中$\frac{n(F{e}_{2}{O}_{3})}{n(C{u}_{2}O)}$<1 | |
| C. | 根据步骤2可以得出蓝色溶液中n(Cu2+)=0.02mol | |
| D. | 根据步骤1、2可以判断出X中氧化铁的质量分数为50% |
11.下列反应中,划线元素被还原的是( )
| A. | 2H2S+SO2═3S↓+2H2O | B. | Zn+CuSO4═Cu+ZnSO4 | ||
| C. | KClO3+6HCl═KCl+3Cl2↑+H2O | D. | 2FeCl2+Cl2═2FeCl3 |
12.下表是元素周期表的一部分,针对表中所列①~⑩元素,填写下列空白.
(1)单质性质最不活泼的元素的原子结构示意图是 .
.
(2)地壳中含量最多的元素在元素周期表中的位置为第二周期ⅥA族.
(3)元素①的气态氢化物的化学式为CH4,其中含有的化学键的类型为极性键.
(4)第三周期元素的最高价氧化物对应水化物中,酸性最强的是HClO4(填化学式,下同),具有两性的是Al(OH)3.
(5)元素⑦的氧化物与氢氧化钠溶液反应的产物是NaAlO2和H2O.
(6)用电子式表示元素⑤与④的化合物的形成过程: .
.
| 周期 族 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
 .
.(2)地壳中含量最多的元素在元素周期表中的位置为第二周期ⅥA族.
(3)元素①的气态氢化物的化学式为CH4,其中含有的化学键的类型为极性键.
(4)第三周期元素的最高价氧化物对应水化物中,酸性最强的是HClO4(填化学式,下同),具有两性的是Al(OH)3.
(5)元素⑦的氧化物与氢氧化钠溶液反应的产物是NaAlO2和H2O.
(6)用电子式表示元素⑤与④的化合物的形成过程:
 .
. 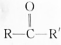 结构);B能与硝酸银的氨溶液作用生成白色沉淀,但C不与之反应.试推测A、B、C的构造式.
结构);B能与硝酸银的氨溶液作用生成白色沉淀,但C不与之反应.试推测A、B、C的构造式.