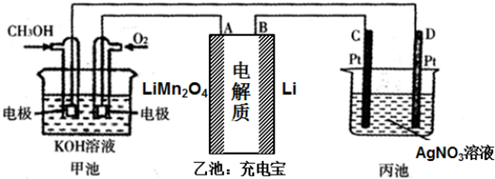
题目内容
4.我国农业因遭受酸雨而造成每年高达15亿多元的损失.为有效地控制酸雨,国务院已批准了《酸雨控制区和二氧化硫污染控制区划分方案》.回答下列问题:
(1)你认为减少酸雨的产生可采取的措施是C
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A.①②③B.②③④⑤C.①③⑤D.①③④⑤
(2)在英国进行的一项研究结果表明:高烟囱可以有效地降低地表面SO2的浓度.在20世纪的60~70年代的10年间,由发电厂排放的SO2增加了35%,但由于建筑高烟囱的结果,地面SO2的浓度降低了30%.请你从全球环境保护的角度,分析这种方法是否可取.简述其理由.
分析 (1)少用煤作燃料、燃料脱硫、开发新的能源等措施可以减少二氧化硫气体的排放,从而减少酸雨的形成.把工厂烟囱造高、在已酸化的土壤中加石灰等措施不能有效地防止酸雨的形成;
(2)建筑高烟囱地面SO2的浓度虽然降低了,但二氧化硫的排放总量不变,且污染范围扩大.
解答 解:(1)酸雨的形成主要是煤等大量含硫燃料的燃烧和石油产品燃烧后产生的SO2造成的,开发新能源,减少含硫煤的使用,燃料脱硫可以减少SO2的排放量,这些措施都是可行的,减少酸雨产生的途径只能是减少SO2的生成量或排放量,因此,把烟囱造高或在已酸化的土壤中加石灰,是不可能减少SO2的排放量的,则少用煤作燃料、燃料脱硫、开发新的能源等措施可以减少二氧化硫气体的排放,从而减少酸雨的形成,
故选:C;
(2)增加烟筒的高度虽然可以使周围地表面SO2的含量减少,但是二氧化硫的排放总量不变,且污染范围扩大了,这种方法是不可取的,故答案为:不可取;二氧化硫的排放总量不变,且污染范围扩大.
点评 本题比较简单,主要考查了酸雨的有关知识,注意二氧化硫是有毒的气体,排放到空气中会造成空气污染,应减少二氧化硫的排放.

练习册系列答案
 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案
相关题目
7.在节日里燃放的烟花能够在空中绚丽地绽放,以下说法中不正确是( )
| A. | 烟花的主要成分黑火药是中国古代四大发明之一 | |
| B. | 烟花爆炸时发生化学变化,释放出热量和气体,把烟花弹射至高空 | |
| C. | 金属镁或金属铝的粉末作为烟花的发光剂在燃烧时发生化学变化,发出白炽的强光 | |
| D. | 金属氧化物作为烟花的发色剂,在火焰中灼烧时发生化学变化,显现出独特的颜色 |
15. (1)已知在常温下,常见弱酸和弱碱的电离平衡常数如下表所示:
(1)已知在常温下,常见弱酸和弱碱的电离平衡常数如下表所示:
浓度均为0.1mol•L-1的下列5种溶液:
①CH3COONH4 ②CH3COONa ③NaNO2 ④HF ⑤NH4Cl,
溶液pH值由小到大的顺序是(填写编号)④⑤①③②.
(2)如图表示某溶液中c(H+)和c(OH-)的关系,下列判断正确的是AC.
A.两条曲线间任意点均有c(H+)×c(OH-)=Kw
B.AB线上任意点均有pH=7
C.图中T1<T2
D.M区域内(阴暗部分)任意点均有c(H+)>c(OH-)
 (1)已知在常温下,常见弱酸和弱碱的电离平衡常数如下表所示:
(1)已知在常温下,常见弱酸和弱碱的电离平衡常数如下表所示:| 电解质 | HF | CH3COOH | HNO2 | NH3•H2O |
| 电离平衡常数K | 3.53×10-4 | 1.76×10-5 | 4.6×10-4 | 1.77×10-5 |
①CH3COONH4 ②CH3COONa ③NaNO2 ④HF ⑤NH4Cl,
溶液pH值由小到大的顺序是(填写编号)④⑤①③②.
(2)如图表示某溶液中c(H+)和c(OH-)的关系,下列判断正确的是AC.
A.两条曲线间任意点均有c(H+)×c(OH-)=Kw
B.AB线上任意点均有pH=7
C.图中T1<T2
D.M区域内(阴暗部分)任意点均有c(H+)>c(OH-)
19.足量金属镁与一定量浓硝酸反应,得到硝酸镁溶液和NO2、NO的混合气体,这些气体与2.52LO2(标准状况)混合后通入水中.所有气体完全被水吸收生成硝酸.若向所得硝酸镁溶液中加入2.5mol/LNaOH溶液至Mg2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
| A. | 45mL | B. | 180mL | C. | 90mL | D. | 135mL |
9.已知CaSO4受热分解,由于受热温度不同,气体成分也不同.气体成分可能为SO2、SO3和O2中的一种、二种或三种.某化学课外活动小组准备通过系列实验探究CaSO4分解生成的气体,进而确定CaSO4分解的化学方程式.
[提出猜想]
Ⅰ.所得气体的成分可能只含 SO3一种;
Ⅱ.所得气体的成分可能含有SO2、O2 二种;(填分子式)
Ⅲ.所得气体的成分可能含有 SO2、SO3、O2三种.
[设计实验]
该化学课外活动小组准备通过测定D装置的增重以及量筒中水的体积,来探究CaSO4分解生成的气体成分,进而确定CaSO4分解的化学方程式.
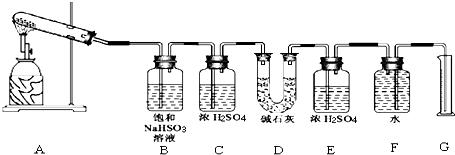
[实验过程]
根据上述实验方案进行试验.已知实验结束时,CaSO4完全分解.
请结合以下实验现象和记录的实验数据进行分析:
(1)若实验结束时,G中量筒没有收集到水,则证明猜想Ⅰ 正确.(填Ⅰ或Ⅱ或Ⅲ)
(2)若实验结束时,装置D的总质量增加,能否断定气体产物中一定含有SO2而不含SO3?请说明理由:不能,因为SO3与B中的饱和NaHSO3反应会生成等物质的量的SO2.
(3)该实验设计中,容易给测定带来较大误差的因素有排水量气法测定气体的体积时量筒和广口瓶中液面变化和压强变化对液体体积的读数会产生误差.
(写出一种即可)
(4)经改进后,有两组同学进行该实验,由于加热时的温度不同,实验测得数据也不同,
相关数据如下:
请通过计算,推断第二组同学得出的CaSO4分解的化学反应方程式:
第二组:2CaSO4$\frac{\underline{\;\;△\;\;}}{\;}$2CaO+2SO2↑+O2↑.
[提出猜想]
Ⅰ.所得气体的成分可能只含 SO3一种;
Ⅱ.所得气体的成分可能含有SO2、O2 二种;(填分子式)
Ⅲ.所得气体的成分可能含有 SO2、SO3、O2三种.
[设计实验]
该化学课外活动小组准备通过测定D装置的增重以及量筒中水的体积,来探究CaSO4分解生成的气体成分,进而确定CaSO4分解的化学方程式.

[实验过程]
根据上述实验方案进行试验.已知实验结束时,CaSO4完全分解.
请结合以下实验现象和记录的实验数据进行分析:
(1)若实验结束时,G中量筒没有收集到水,则证明猜想Ⅰ 正确.(填Ⅰ或Ⅱ或Ⅲ)
(2)若实验结束时,装置D的总质量增加,能否断定气体产物中一定含有SO2而不含SO3?请说明理由:不能,因为SO3与B中的饱和NaHSO3反应会生成等物质的量的SO2.
(3)该实验设计中,容易给测定带来较大误差的因素有排水量气法测定气体的体积时量筒和广口瓶中液面变化和压强变化对液体体积的读数会产生误差.
(写出一种即可)
(4)经改进后,有两组同学进行该实验,由于加热时的温度不同,实验测得数据也不同,
相关数据如下:
| 实验小组 | 称取CaSO4 的质量(g) | 装置D增加 的质量(g) | 量取气体体积的装置测量的气体体积 (折算成标准状况下气体的体积) (mL) |
| 一 | 4.08 | 2.56 | 224 |
| 二 | 5.44 | 2.56 | 448 |
第二组:2CaSO4$\frac{\underline{\;\;△\;\;}}{\;}$2CaO+2SO2↑+O2↑.
13.取x g铜镁合金完全溶于浓硝酸中,反应过程中硝酸被还原只产生8960mL的NO2气体和672mL的N2O4气体(都已折算到标准状态),在反应后的溶液中加足量的氢氧化钠溶液,生成沉淀质量为17.02g.下列判断不正确的是( )
| A. | 参加反应的硝酸是0.92 mol | |
| B. | 合金中镁的质量5.9 g | |
| C. | 反应过程中转移的电子数为0.46 mol | |
| D. | 合金中含有铜0.092 mol |
14.下列物质属于含有共价键的离子化合物的是( )
| A. | Na2O2 | B. | H2O | C. | MgCl2 | D. | N2 |