题目内容
下列各组顺序的排列不正确的是( )
| A、离子半径:Na+>Mg2+>Al3+>F- |
| B、热稳定性:HCl>H2S>PH3 |
| C、酸性强弱:Al(OH)3<H2SiO3<H2CO3<H3PO4 |
| D、熔点:SiO2>NaCl>Na>CO2 |
考点:微粒半径大小的比较,非金属在元素周期表中的位置及其性质递变的规律,晶体的类型与物质熔点、硬度、导电性等的关系
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:A.电子层结构相同,核电荷数越大离子半径越小;
B.非金属性越强,氢化物越稳定;
C.非金属性越强,最高价氧化物对应水化物的酸性越强;
D.熔点:原子晶体>离子晶体>分子晶体,而Na为金属晶体,熔点高于二氧化碳、低于氯化钠.
B.非金属性越强,氢化物越稳定;
C.非金属性越强,最高价氧化物对应水化物的酸性越强;
D.熔点:原子晶体>离子晶体>分子晶体,而Na为金属晶体,熔点高于二氧化碳、低于氯化钠.
解答:
解:A.Na+、Mg2+、Al3+、F-电子层结构相同,核电荷数越大离子半径越小,故离子半径:F->Na+>Mg2+>Al3+,故A错误;
B.同周期自左而右非金属性减弱,非金属性越强,氢化物越稳定,故氢化物稳定性:HCl>H2S>PH3,故B正确;
C.非金属性Al<Si<C<P,最高价氧化物对应水化物的酸性:Al(OH)3<H2SiO3<H2CO3<H3PO4,故C正确;
D.SiO2属于原子晶体,NaCl属于离子晶体,CO2属于分子晶体,熔点:原子晶体>离子晶体>分子晶体,而Na为金属晶体,熔点高于二氧化碳、低于氯化钠,故熔点SiO2>NaCl>Na>CO2,故D正确,
故选A.
B.同周期自左而右非金属性减弱,非金属性越强,氢化物越稳定,故氢化物稳定性:HCl>H2S>PH3,故B正确;
C.非金属性Al<Si<C<P,最高价氧化物对应水化物的酸性:Al(OH)3<H2SiO3<H2CO3<H3PO4,故C正确;
D.SiO2属于原子晶体,NaCl属于离子晶体,CO2属于分子晶体,熔点:原子晶体>离子晶体>分子晶体,而Na为金属晶体,熔点高于二氧化碳、低于氯化钠,故熔点SiO2>NaCl>Na>CO2,故D正确,
故选A.
点评:本题考查微粒半径比较、元素周期律、熔沸点高低比较等,难度不大,注意对元素周期律的理解及熔沸点高低的比较.

练习册系列答案
 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案
相关题目
将标准状况下的甲烷11.2L与22.4L O2混合后点燃,恢复到原状况时,气体的体积为( )
| A、11.2 L |
| B、33.6 L |
| C、22.4 L |
| D、44.8 L |
已知34Se和35Br位于同一周期,下列关系正确的是( )
| A、原子半径:Br>Se>Cl |
| B、热稳定性:HCl>H2Se>HBr |
| C、酸性:H2SeO4>HBrO4>HClO4 |
| D、还原性:Se2->Br->Cl- |
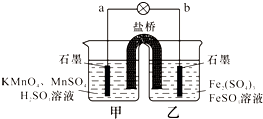 某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O盐桥中装有饱和K2SO4溶液,下列叙述中正确的是( )
某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O盐桥中装有饱和K2SO4溶液,下列叙述中正确的是( )| A、乙烧杯中发生还原反应 |
| B、甲烧杯中溶液的pH逐渐减小 |
| C、电池工作时,盐桥中的SO42-移向甲烧杯 |
| D、外电路的电流方向是从a到b |
与I2<Br2<Cl2<F2的变化规律(由弱到强或由低到高或由难到易)不符合的是( )
| A、与氢气反应的难易程度 |
| B、氧化性的强弱 |
| C、氢化物的熔沸点 |
| D、氢化物稳定性 |
 反应aA(g)+bB(g)?cC(g)△H=-Q,生成物C的质量分数与压强P和温度T的关系如图,方程式中的系数和Q值符合图象的是( )
反应aA(g)+bB(g)?cC(g)△H=-Q,生成物C的质量分数与压强P和温度T的关系如图,方程式中的系数和Q值符合图象的是( )| A、a+b<c Q>0 |
| B、a+b>c Q<0 |
| C、a+b<c Q<0 |
| D、a+b=c Q>0 |
根据热化学方程式:S(g)+O2(g)?SO2(g)△H=-QkJ?mol-1(Q>0),下列分析正确的是( )
| A、1mol S(g)与1mol O2(g)反应生成1mol SO2(g)放出QkJ的热量 |
| B、1个S(g)与1个O2(g)完全反应要放出Q kJ的热量 |
| C、S(s)+O2(g)?SO2(g)△H<-Q kJ?mol-1 |
| D、1mol S(g)与1mol O2(g)的总能量比1mol SO2(g)的总能量低Q kJ |
A、B、C、D、E为五种短周期元素,原子序数依次递增.其中A、C、E为连续三个周期的元素,B、E同族,C最外层电子数是D最外层电子数的3倍,A、B、C、D、E的最外层电子数之和为17.下列说法正确的是( )
| A、原子半径:D>E>C>B>A |
| B、E的氧化物熔点很高,是由于其相对分子质量大 |
| C、D的单质能与B的氧化物发生置换反应 |
| D、由A、B、C元素组成的物质只有一种 |