题目内容
12.一定温度下,Mg(OH)2固体在水中达到沉淀溶解平衡:Mg(OH)2(s)?Mg2+(aq)+2OH-(aq).要使Mg(OH)2固体质量减少而[Mg2+]不变,采取的措施可能是( )| A. | 加适量水 | B. | 通HCl气体 | C. | 加NaOH固体 | D. | 加MgSO4 固体 |
分析 因Ksp不变,而[Mg2+]不变,则[OH-]不变,说明仍为饱和溶液,应加水促进溶解,以此解答该题.
解答 解:A.加水促进溶解,固体质量减少而[Mg2+]不变,仍为饱和溶液,故A正确;
B.加入HCl,发生酸碱中和反应,[Mg2+]浓度增大,故B错误;
C.加NaOH固体,[OH-]增大,抑制水解,故C错误;
D.加MgSO4 固体,[Mg2+]增大,故D错误.
故选A.
点评 本题考查难溶电解质的溶解平衡,为高频考点,侧重于学生的分析能力的考查,注意从浓度的角度把握平衡移动的影响,难度不大.

练习册系列答案
相关题目
17.以下对影响反应方向的因素的判断错误的是( )
| A. | 有时焓变起决定性作用 | |
| B. | 有时熵变起决定性作用 | |
| C. | 焓变和熵变是两个主要因素 | |
| D. | 温度不可能对反应方向起决定性作用 |
18.下列关于氯水的叙述正确的是( )
| A. | 新制氯水可使蓝色石蕊试纸先变红后褪色 | |
| B. | 光照氯水有气泡放出,该气体是Cl2 | |
| C. | 新制氯水中只含Cl2和H2O分子 | |
| D. | 氯水放置数天后酸性将变弱 |
15.两种气态烃组成的混合气体0.1mol,完全燃烧得0.16molCO2和3.6g水,下列说法不正确的是( )
| A. | 混合气体中一定有甲烷 | B. | 混合气体中一定没有乙烯 | ||
| C. | 混合气体中一定没有乙烷 | D. | 混合气体中可能含有C3H4 |
7.已知lg2=0.3,KSP[Cr(OH)3]=6.4×10-31.某工厂进行污水处理时,要使污水中的Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×10-5时,可以认为Cr3+沉淀完全,溶液的pH至少为( )
| A. | 4.4 | B. | 5.6 | C. | 6.7 | D. | 8.4 |
17.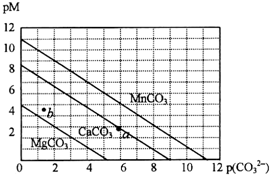 一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如下图所示.已知:pM=-lg c(M),p(CO32-)=-lg c(CO32-).下列说法正确的是( )
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如下图所示.已知:pM=-lg c(M),p(CO32-)=-lg c(CO32-).下列说法正确的是( )
 一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如下图所示.已知:pM=-lg c(M),p(CO32-)=-lg c(CO32-).下列说法正确的是( )
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如下图所示.已知:pM=-lg c(M),p(CO32-)=-lg c(CO32-).下列说法正确的是( )| A. | M离子浓度越大,pM值越大 | |
| B. | MgCO3、CaCO3、MnCO3的Ksp依次增大 | |
| C. | b点表示MgCO3为不饱和溶液,若表示CaCO3则有沉淀析出 | |
| D. | a点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32-) |
2.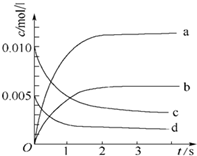 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:
(1)800℃时,反应达到平衡时,NO的物质的量浓度是0.0035mol/L.
(2)图中表示NO2的变化的曲线是b.用O2表示从0~2s内 该反应的平均速率v=1.5×10-3mol•L-1•s-1
(3)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2) b.容器内压强保持不变 c.v正(NO)=2v逆(O2) d.容器内密度保持不变
(4)能使该反应的反应速率增大的是bcd.
a.及时分离出NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂.
(5)平衡时NO的转化率为:65%.
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)图中表示NO2的变化的曲线是b.用O2表示从0~2s内 该反应的平均速率v=1.5×10-3mol•L-1•s-1
(3)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2) b.容器内压强保持不变 c.v正(NO)=2v逆(O2) d.容器内密度保持不变
(4)能使该反应的反应速率增大的是bcd.
a.及时分离出NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂.
(5)平衡时NO的转化率为:65%.
 .
.