题目内容
12. “8•12”天津港危化仓库爆炸,造成生命、财产的特大损失.据查危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN).请回答下列问题:
“8•12”天津港危化仓库爆炸,造成生命、财产的特大损失.据查危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN).请回答下列问题:(1)NaCN属于剧毒物质,有多种无害化处理方法
①H2O2处理法:NaCN+H2O2--N2↑+X+H2O,推测X的化学式为NaHCO3,双氧水的电子式为
 .
.②NaClO处理法:aCN-+bClO-+2cOH-=dCNO-+eN2↑+fCO32-+bCl-+cH2O. 方程式中e:f的值为B(填选项标号).
A.1 B.$\frac{1}{2}$ C.2D.不能确定
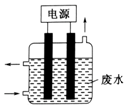
③用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,某电极上产生的ClO-将CN-氧化为两种无污染的气体,则电解过程中,阳极的电极反应式为Cl-+2OH--2e-═ClO-+H2O.
(2)以TiO2为催化剂用NaClO将CN-离子氧化成CNO-,CNO-在酸性条件下继续与NaClO反应生成N2、CO2、Cl2等.取浓缩后含CN-离子的废水与过量NaClO溶液的混合液共200mL(设其中CN-的浓度为0.2mol•L-1)进行实验. 写出CNO-在酸性条件下被NaClO氧化的离子方程式:2CNO-+6ClO-+8H+═N2↑+2CO2↑+3Cl2↑+4H2O.
分析 (1)①根据元素守恒确定X中元素,根据转移电子守恒、原子守恒确定X化学式;双氧水属于共价化合物,双氧水中两个氢原子分别与两个氧原子通过共用一对电子结合,两个氧原子之间通过共用1对电子结合;
②由CN-离子中碳与氮原子之比为1:1,而碳氮转化为CNO-和N2以及CO32-,因为CNO-离子碳氮之比为1:1,所以N2和CO32-两微粒之比为1:2;
③阳极上氯离子失电子生成氯气,氯气和氢氧根离子反应生成次氯酸根离子和水;
(2)根据题意可知,酸性条件下CNO-与NaClO反应生成N2、CO2和Cl2,根据氧化还原反应配平.
解答 解:(1)①根据元素守恒知,X中含有Na、C元素,该反应中N元素化合价由-3价转化为0价、NaCN中C元素化合价为+2价,则C元素化合价由+2价转化为+4价,转移电子数为6,根据转移电子守恒、原子守恒知X为NaHCO3,双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为: ;
;
故答案为:NaHCO3; ;
;
②由CN-离子中碳与氮原子之比为1:1,而碳氮转化为CNO-和N2以及CO32-,以因为CNO-离子碳氮之比为1:1,所以N2和CO32-两微粒之比为1:2,所以e:f=1:2,
故答案为:B;
③阳极上氯离子失电子生成氯气,氯气和氢氧根离子反应生成次氯酸根离子和水,所以阳极反应式为Cl-+2OH--2e-═ClO-+H2O;
故答案为:Cl-+2OH--2e-═ClO-+H2O;
(2)根据题意可知,酸性条件下CNO-与NaClO反应生成N2、CO2和Cl2,反应离子方程式为2CNO-+6ClO-+8H+═N2↑+2CO2↑+3Cl2↑+4H2O,
故答案为:2CNO-+6ClO-+8H+═N2↑+2CO2↑+3Cl2↑+4H2O.
点评 本题考查氧化还原反应的计算及含量测定、电解原理的应用等,题目综合性较强,注重高频考点的考查,侧重分析与计算能力的考查,注意反应中元素的化合价变化,题目难度中等.

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案| A. | 铝制容器可盛装热的浓硫酸 | |
| B. | 将稀硫酸滴加到Fe(NO3)2溶液中无明显现象 | |
| C. | K与水反应比Li与水反应剧烈 | |
| D. | 用氢氧化钠溶液吸收二氧化氮时有一氧化氮生成 |
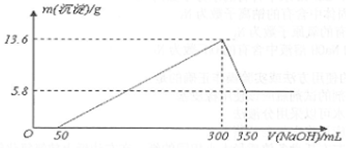
 常温下,向50mL溶有0.1molCl2的氯水中滴加2mol/L的NaOH溶液,得到溶液pH随所加NaOH溶液体积的变化图象如下.下列说法正确的是( )
常温下,向50mL溶有0.1molCl2的氯水中滴加2mol/L的NaOH溶液,得到溶液pH随所加NaOH溶液体积的变化图象如下.下列说法正确的是( )| A. | 若a点pH=4,且c(Cl-)=m c(ClO-),则Ka(HClO)=$\frac{1{0}^{-4}}{m+1}$ | |
| B. | 若x=100,b点对应溶液中:c(OH-)>c(H+),可用pH试纸测定其pH | |
| C. | 若y=200,c点对应溶液中:c(OH-)-c(H+)=2c(Cl-)+c(HClO) | |
| D. | b~c段,随NaOH溶液的滴入,$\frac{c(HClO)}{c(Cl{O}^{-})}$逐渐增大 |
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将浓硫酸滴加到蔗糖中搅拌 | 固体变黑膨胀 | 浓硫酸有吸水性 |
| B | 将盐酸缓缓滴入Na2CO3溶液中 | 无气泡产生 | 二者不反应 |
| C | 向某溶液中加入浓NaOH溶液并加热,在试管口用湿润红色石蕊纸检验 | 试纸变蓝 | 原溶液中含有NH4+ |
| D | 向氢氧化铁胶体中滴加氯化铵饱和溶液 | 产生沉淀 | 沉淀为FeCl3 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 | |
| B. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| C. | MgO的熔点很高,可用于制作耐高温材料 | |
| D. | 光导纤维属于硅酸盐产品 |
 研究硫元素及其化合物的性质具有重要意义.
研究硫元素及其化合物的性质具有重要意义.(1)①硫离子的结构示意图为
 .
.②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O.
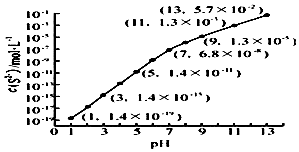
(2)25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-) 关系如右图(忽略溶液体积的变化、H2S的挥发).
①pH=13时,溶液中的c(H2S)+c(HS-)=0.043mol•L-1.
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-4 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
(3)25℃,两种酸的电离平衡常数如表.
足量NaHSO3溶液与NaHCO3溶液反应的离子方程式为2HSO3-+CO32-=2SO32-+CO2↑+H2O.
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | VⅡA | |
| 二 | a | b | c | ||||
| 三 | d | e | f | g | h | i |
②h、i两种元素阴离子的还原性:h>i
③a、g两种元素的氢化物的稳定性:a>g
④d、e、f三种元素的最高价氧化物对应的水化物碱性依次增强
⑤九种元素中d元素的单质还原性最强.
| A. | ①③④ | B. | ②③⑤ | C. | ②④⑤ | D. | ①③⑤ |
| A. | 平衡时C的转化率:乙>甲 | B. | 平衡时C的物质的量甲<乙 | ||
| C. | 平均反应速度:乙>甲 | D. | 平衡时A的物质的量甲>乙 |