题目内容
将高碘酸H5IO6加入MnSO4溶液中可使溶液呈紫红色,已知H5IO6在反应中发生如下过程:H5IO6→HIO3.完成下列填空:
(1)将该反应的氧化剂、还原剂及配平后的系数填入图中正确位置.
(2)在图中标明电子转移的方向和数目.

(3)若向H5IO6溶液中加入足量的下列物质,能将碘元素还原成碘离子的是 (选填序号).
a.盐酸b.硫化氢c.溴化钠d.硫酸亚铁.
(1)将该反应的氧化剂、还原剂及配平后的系数填入图中正确位置.
(2)在图中标明电子转移的方向和数目.

(3)若向H5IO6溶液中加入足量的下列物质,能将碘元素还原成碘离子的是
a.盐酸b.硫化氢c.溴化钠d.硫酸亚铁.
考点:氧化还原反应
专题:氧化还原反应专题
分析:高碘酸H5IO6加入MnSO4溶液中可使溶液呈紫红色,这说明反应中有高锰酸钾生成,因此高碘酸是氧化剂,硫酸锰是还原剂;其中I元素的化合价从+7价降低到+5价,得到2个电子;Mn元素的化合价从+2价升高到+7价,失去5个电子,根据电子得失守恒和原子守恒分析.
解答:
解:(1)高碘酸H5IO6加入MnSO4溶液中可使溶液呈紫红色,这说明反应中有高锰酸钾生成,因此高碘酸是氧化剂,硫酸锰是还原剂;其中I元素的化合价从+7价降低到+5价,得到2个电子;Mn元素的化合价从+2价升高到+7价,失去5个电子,所以根据电子得失守恒可知,氧化剂与还原剂的物质的量之比是5:2, ;
;
故答案为: ;
;
(2)I元素的化合价从+7价降低到+5价,得到2个电子,5个碘原子得到10个电子;Mn元素的化合价从+2价升高到+7价,失去5个电子,2个Mn原子失去10个电子,因此电子转移的方向和数目为 ;
;
故答案为: ;
;
(3)由于氯气、单质溴以及铁离子的氧化性均强于单质碘的,所以选项acd不可能将高碘酸还原为碘离子,单质碘的氧化性强于S的,因此H2S可以把高碘酸还原为碘离子,
故答案为:b.
 ;
;故答案为:
 ;
;(2)I元素的化合价从+7价降低到+5价,得到2个电子,5个碘原子得到10个电子;Mn元素的化合价从+2价升高到+7价,失去5个电子,2个Mn原子失去10个电子,因此电子转移的方向和数目为
 ;
;故答案为:
 ;
;(3)由于氯气、单质溴以及铁离子的氧化性均强于单质碘的,所以选项acd不可能将高碘酸还原为碘离子,单质碘的氧化性强于S的,因此H2S可以把高碘酸还原为碘离子,
故答案为:b.
点评:本题考查氧化还原反应,侧重基本概念及转移电子数的考查,明确反应中元素的化合价变化即可解答,题目难度不大.

练习册系列答案
相关题目
一种新型火箭燃料1,3,3-三硝基氮杂环丁烷(TNAZ)的结构如图所示.下列有关TNAZ的说法正确的是( )


| A、分子中N、O间形成的共价键是非极性键 |
| B、该物质既有氧化性又有还原性 |
| C、C、N、O的第一电离能从大到小的顺序为O>N>C |
| D、C、N、0的气态氢化物的沸点依次降低 |
MOH和ROH两种一元碱,其水溶液分别加水稀释时,pH变化如图所示.下列叙述中正确的是:( )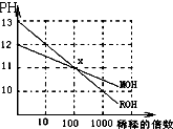

| A、在x点,ROH未完全电离 |
| B、在x点,c(M+)>c(R+) |
| C、稀释前,c(ROH)=10c(MOH) |
| D、pH=2的盐酸与pH=12的MOH等体积混合后,溶液显碱性 |
工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下,下列叙述正确的是( )


| A、反应①中试剂X是氢氧化钠溶液 |
| B、反应①、过滤后所得沉淀为氢氧化铁 |
| C、图中所示转化反应中包含一个氧化还原反应 |
| D、将试剂X和Y进行对换,最终可以达到相同的效果 |
欲除去下列物质中混入的少量杂质(括号内物质为杂质),不能达到目的是( )
| A、乙酸乙酯(乙酸):加饱和Na2CO3溶液,充分振荡静置后,分液 |
| B、乙醇(水):加入新制生石灰,蒸馏 |
| C、溴苯(溴):加入NaOH溶液,充分振荡静置后,分液 |
| D、乙酸(乙醇):加入金属钠,蒸馏 |




 )和多巴胺的结构相似,它的核磁共振氢谱中可以发现有
)和多巴胺的结构相似,它的核磁共振氢谱中可以发现有 A、B、C、D四种物质的转化关系如图所示(反应条件及其产物乙略去),请回答下列问题:
A、B、C、D四种物质的转化关系如图所示(反应条件及其产物乙略去),请回答下列问题: