题目内容
MOH和ROH两种一元碱,其水溶液分别加水稀释时,pH变化如图所示.下列叙述中正确的是:( )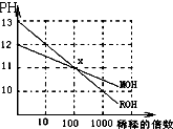

| A、在x点,ROH未完全电离 |
| B、在x点,c(M+)>c(R+) |
| C、稀释前,c(ROH)=10c(MOH) |
| D、pH=2的盐酸与pH=12的MOH等体积混合后,溶液显碱性 |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:由图可知,ROH开始的pH=13,稀释100倍pH=11,则ROH为强碱,而MOH开始的pH=12,稀释100倍pH=11,则MOH为弱碱;并根据酸碱中和及电离来解答.
解答:
解:A.由图可知,ROH开始的pH=13,稀释100倍pH=11,则ROH为强碱,完全电离,故A错误;
B.由ROH═R++OH-,MOH?M++OH-可知,在x点,c(OH-)相等,则c(M+)=c(R+),故B错误;
C.稀释前,c(ROH)=0.1mol/L,c(MOH)>0.01mol/L,则c(ROH)<10c(MOH),故C错误;
D.pH=2的盐酸与pH=12的MOH溶液中c(H+)=c(OH-),因MOH为弱碱,则MOH浓度较大,等体积混合后,MOH过量,溶液呈碱性,故D正确.
故选D.
B.由ROH═R++OH-,MOH?M++OH-可知,在x点,c(OH-)相等,则c(M+)=c(R+),故B错误;
C.稀释前,c(ROH)=0.1mol/L,c(MOH)>0.01mol/L,则c(ROH)<10c(MOH),故C错误;
D.pH=2的盐酸与pH=12的MOH溶液中c(H+)=c(OH-),因MOH为弱碱,则MOH浓度较大,等体积混合后,MOH过量,溶液呈碱性,故D正确.
故选D.
点评:本题考查电解质在水中的电离及图象,为高频考点,侧重于学生的分析能力的考查,明确图象中pH的变化及交点的意义是解答本题的关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
雌黄与浓硝酸反应如下:As2S3+28HNO3(浓)?2H3As04+3H2S04+28N02↑+8H2O,下列说法正确的是( )
| A、氧化产物只有H2S04 |
| B、1mol As2S3发生反应,有28 mol电子转移 |
| C、该反应中As2S3既是氧化剂又是还原剂 |
| D、As2S3不可能与氧气反应 |
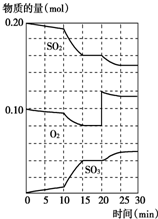 600℃时,在一固定容积的密闭容器中,将二氧化硫和氧气混合发生反应:2SO2(g)+O2(g)?2SO3(g)△H<0.反应过程中SO2、O2、SO3物质的量的变化如图,下列说法错误的是( )
600℃时,在一固定容积的密闭容器中,将二氧化硫和氧气混合发生反应:2SO2(g)+O2(g)?2SO3(g)△H<0.反应过程中SO2、O2、SO3物质的量的变化如图,下列说法错误的是( )| A、反应从开始到第一次平衡时,二氧化硫的转化率为20% |
| B、10~15 min和20~25min相比,前者的化学反应速率大 |
| C、反应进行至20min时,曲线发生变化是因为通入了氧气 |
| D、反应进行到10min~15 min的曲线变化原因一定是增大了压强 |
我国化学家侯德榜根据NaHCO3溶解度比NaCl、Na2CO3、NH4HCO3、NH4Cl都小的性质,运用CO2+NH3+H2O+NaCl=NaHCO3↓+NH4Cl的反应原理制备纯碱.如图是在实验室进行模拟实验的生产流程示意图:气体A的饱和溶液
A和食盐的饱和溶液
悬浊液
晶体
纯碱,则下列叙述错误的是( )
| 加入食盐 |
| Ⅰ |
| 通入足量气体B |
| Ⅱ |
| 过滤 |
| Ⅲ |
| Ⅳ |
| A、A气体是NH3,B气体是CO2 |
| B、第Ⅲ步得到的晶体是发酵粉的主要成分 |
| C、第Ⅲ步操作用到的主要玻璃仪器是烧杯、漏斗、玻璃棒 |
| D、第Ⅳ步操作的主要过程有溶解、蒸发、结晶 |
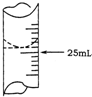 欲测定某NaOH溶液的物质的量浓度,可用物质的量浓度为0.1000mol?L-1 HCl标准溶液进行中和滴定(用酚酞作指示剂).
欲测定某NaOH溶液的物质的量浓度,可用物质的量浓度为0.1000mol?L-1 HCl标准溶液进行中和滴定(用酚酞作指示剂).
 )(用反应流程图表示).
)(用反应流程图表示).