题目内容
瑞美替昂是一种褪黑素受体激动剂类镇静催眠药,化学物X是它的一种中间体,可由下列路线合成(部分反应条件已略去):

回答下列问题:
(1)C中含有的含氧官能团的名称是 ;反应①的反应类型为 .
(2)反应④的化学方程式为 .
(3)反应③会生成与D互为同分异构体的副产物,生成该副产物的化学方程式是 .
(4)检查E中是否含有F可选用的试剂是 (任写一种).
(5)同时满足下列条件的物质X的芳香族同分异构体的结构简式是 (写一种即可).
①能发生银镜反应 ②能发生水解反应 ③核磁共振氢谱显示5组吸收峰
(6)常温下,下列物质能与A发生反应的有 .
A、银氨溶液 b、浓溴水 c、NaOH溶液 d、酸性KMnO4溶液.

回答下列问题:
(1)C中含有的含氧官能团的名称是
(2)反应④的化学方程式为
(3)反应③会生成与D互为同分异构体的副产物,生成该副产物的化学方程式是
(4)检查E中是否含有F可选用的试剂是
(5)同时满足下列条件的物质X的芳香族同分异构体的结构简式是
①能发生银镜反应 ②能发生水解反应 ③核磁共振氢谱显示5组吸收峰
(6)常温下,下列物质能与A发生反应的有
A、银氨溶液 b、浓溴水 c、NaOH溶液 d、酸性KMnO4溶液.
考点:有机物的结构和性质,有机物的合成
专题:有机物的化学性质及推断
分析:(1)根据C的结构,则含有的含氧官能团的名称为醚键;对比A、B的结构可知,A中酚羟基中H原子被取代生成B;
(2)根据流程反应④为D与氢气发生加成反应;
(3)反应③是取代反应,取代的位置是碳碳双键两端的碳原子上,故生成的副产物为 ,同时生成HBr;
,同时生成HBr;
(4)根据(2)的反应,E为酯,而F为羧酸,所以根据能与羧酸反应而不与酯反应并且有现象产生的试剂来检查E中是否含有F;
(5)同分异构体满足:①能发生银镜反应;②能发生水解反应,含有甲酸形成的酯基,③分子的核磁共振氢谱有5个峰,结合X结构可知,还含有2个-CH=CH2,且为对称结构;
(6)根据A的结构含有溴原子和酚羟基来判断.
(2)根据流程反应④为D与氢气发生加成反应;
(3)反应③是取代反应,取代的位置是碳碳双键两端的碳原子上,故生成的副产物为
 ,同时生成HBr;
,同时生成HBr;(4)根据(2)的反应,E为酯,而F为羧酸,所以根据能与羧酸反应而不与酯反应并且有现象产生的试剂来检查E中是否含有F;
(5)同分异构体满足:①能发生银镜反应;②能发生水解反应,含有甲酸形成的酯基,③分子的核磁共振氢谱有5个峰,结合X结构可知,还含有2个-CH=CH2,且为对称结构;
(6)根据A的结构含有溴原子和酚羟基来判断.
解答:
解:(1)由C的结构,则含有的含氧官能团的名称为醚键;对比A、B的结构可知,A中酚羟基中H原子被取代生成B,属于取代反应,故答案为:醚键;取代反应;
(2)反应④为D与氢气发生加成反应,化学方程式为 ,故答案为:
,故答案为: ;
;
(3)反应③是取代反应,取代的位置是碳碳双键两端的碳原子上,故生成的副产物为 ,同时生成HBr,反应方程式为:
,同时生成HBr,反应方程式为: ,
,
故答案为: ;
;
(4)根据(2)的反应,E为酯,而F为羧酸,根据羧酸与NaHCO3溶液反应产生气泡,而酯不与之反应,所以选用NaHCO3溶液来检查E中是否含有F,故答案为:NaHCO3溶液;
(5)X的同分异构体满足:①能发生银镜反应;②能发生水解反应,含有甲酸形成的酯基,③分子的核磁共振氢谱有5个峰,结合X的结构可知,还含有2个-CH=CH2,且为对称结构,符合条件的同分异构体为: 或
或 ,
,
故答案为: 或
或 ;
;
(6)由A的结构含有溴原子和酚羟基,所以常温下,可以与溴水发生取代反应,与氢氧化钠发生中和反应,可以被酸性高锰酸钾氧化,但不含醛基,不能与银氨溶液反应,故选:bcd.
(2)反应④为D与氢气发生加成反应,化学方程式为
 ,故答案为:
,故答案为: ;
;(3)反应③是取代反应,取代的位置是碳碳双键两端的碳原子上,故生成的副产物为
 ,同时生成HBr,反应方程式为:
,同时生成HBr,反应方程式为: ,
,故答案为:
 ;
;(4)根据(2)的反应,E为酯,而F为羧酸,根据羧酸与NaHCO3溶液反应产生气泡,而酯不与之反应,所以选用NaHCO3溶液来检查E中是否含有F,故答案为:NaHCO3溶液;
(5)X的同分异构体满足:①能发生银镜反应;②能发生水解反应,含有甲酸形成的酯基,③分子的核磁共振氢谱有5个峰,结合X的结构可知,还含有2个-CH=CH2,且为对称结构,符合条件的同分异构体为:
 或
或 ,
,故答案为:
 或
或 ;
;(6)由A的结构含有溴原子和酚羟基,所以常温下,可以与溴水发生取代反应,与氢氧化钠发生中和反应,可以被酸性高锰酸钾氧化,但不含醛基,不能与银氨溶液反应,故选:bcd.
点评:本题以有机物的合成考查有机物结构与性质、有机反应类型、同分异构体书写等,是对有机化学的综合考查,主要对学生分析推理与知识迁移运用能力的锻炼,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列状态的物质,既属于电解质又能导龟的是( )
| A、氯化镁晶体 |
| B、氯化钠溶液 |
| C、液态氯化氢 |
| D、熔融氢氧化钾 |
在相同条件下,若A容器中的氢气与B容器中的氨气(NH3)所含原子数相等,则两个容器的体积比为( )
| A、1:2 | B、1:3 |
| C、2:3 | D、2:1 |
日本大地震引发的福岛第一核电站核泄漏事故,造成放射性物质
I和
Cs向外界泄漏.下列相关说法正确的是( )
131 53 |
137 55 |
A、每个
| ||
| B、CsOH的碱性比NaOH弱 | ||
| C、KIO3是碘的最高价氧化物的水化物的盐 | ||
| D、I-比F-还原性强 |
常温下,某弱酸的酸式盐NaHA溶液中,c(OH-)<c(A2-),下列有关溶液的说法中正确的是( )
| A、溶液的PH>7 |
| B、溶液中c(Na+)=2c(A2-)+c(HA)+c(H2A) |
| C、加水稀释,c(A2-)/c(HA-)减小 |
| D、加入NaOH固体,可使离子浓度满足:c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+) |
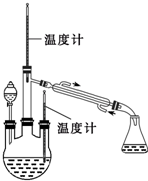 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4?H2O).CO(NH2)+2NaOH+NaClO=Na2CO3+N2H4?H2O+NaCl
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4?H2O).CO(NH2)+2NaOH+NaClO=Na2CO3+N2H4?H2O+NaCl
 )
)