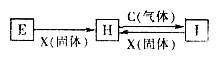题目内容
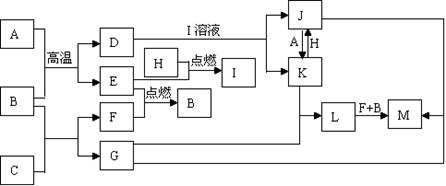
(10分)下列框图中,已知A、E、F、H是单质,其中只有A是固体,其它都是气体,且H是呈黄绿色;B是最常见液体,G的焰色反应呈黄色,L是白色沉淀,M是红褐色沉淀。部分反应的某些产物未标出。
(1)写出H的化学式: 、C的电子式: 。
(2)写出D与I溶液发生反应的离子方程式: 。
(3)写出L→M的化学方程式: 。
(4)检验J中的阳离子时,不宜选用下列试剂中的 (填选项字母)。
A.Fe粉 B.NaOH溶液 C.KSCN溶液

(1)写出H的化学式: 、C的电子式: 。
(2)写出D与I溶液发生反应的离子方程式: 。
(3)写出L→M的化学方程式: 。
(4)检验J中的阳离子时,不宜选用下列试剂中的 (填选项字母)。
A.Fe粉 B.NaOH溶液 C.KSCN溶液
(1)Cl2 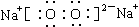 (2)Fe3O4 + 8H+ = Fe2+ + 2Fe3+ + 4H2O
(2)Fe3O4 + 8H+ = Fe2+ + 2Fe3+ + 4H2O
(3)4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 (4)A
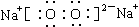 (2)Fe3O4 + 8H+ = Fe2+ + 2Fe3+ + 4H2O
(2)Fe3O4 + 8H+ = Fe2+ + 2Fe3+ + 4H2O(3)4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 (4)A
试题分析:根据题意可知A的Fe;B是H2O;D是Fe3O4;E是H2;H是Cl2;I是HCl;C是Na2O2;Na2O2与水反应得到G:NaOH和F:O2;Fe3O4与HCl发生反应得到FeCl2、FeCl3; FeCl2与Cl2发生反应得到FeCl3;FeCl3与Fe发生反应得到FeCl2.因此J是FeCl3;K是FeCl2。NaOH和FeCl2发生反应得到Fe(OH)2和NaCl.根据物质的转化关系可知L是Fe(OH)2;Fe(OH)2与氧气在水存在下发生反应:4Fe(OH)2 + O2+2H2O == 4Fe(OH)3。故M是Fe(OH)3。NaOH与FeCl3也能发生反应得到Fe(OH)3,同时还产生NaCl。(1)H是Cl2;C Na2O2的电子式是
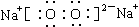 ;(2)根据离子方程式书写的原则,D Fe3O4与HCl溶液发生反应的离子方程式:Fe3O4 + 8H+ = Fe2+ + 2Fe3+ + 4H2O;(3)Fe(OH)2→Fe(OH)3的化学方程式是:4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3;(4)检验FeCl3中的阳离子时,A.若加入Fe粉 或Al粉等活泼金属单质时,都会使溶液中的Fe3+变为Fe2+,溶液由黄色变为浅绿色。因此不能选择Fe粉来检验,错误。B.加入NaOH溶液,会发生沉淀反应,产生红褐色Fe(OH)3沉淀。可以鉴别。正确。C.加入KSCN溶液,会发生显色反应:Fe3++3SCN—=Fe(SCN)3,溶液变为血红色。因此可以作鉴别试剂。正确。故选项为A。
;(2)根据离子方程式书写的原则,D Fe3O4与HCl溶液发生反应的离子方程式:Fe3O4 + 8H+ = Fe2+ + 2Fe3+ + 4H2O;(3)Fe(OH)2→Fe(OH)3的化学方程式是:4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3;(4)检验FeCl3中的阳离子时,A.若加入Fe粉 或Al粉等活泼金属单质时,都会使溶液中的Fe3+变为Fe2+,溶液由黄色变为浅绿色。因此不能选择Fe粉来检验,错误。B.加入NaOH溶液,会发生沉淀反应,产生红褐色Fe(OH)3沉淀。可以鉴别。正确。C.加入KSCN溶液,会发生显色反应:Fe3++3SCN—=Fe(SCN)3,溶液变为血红色。因此可以作鉴别试剂。正确。故选项为A。
练习册系列答案
相关题目
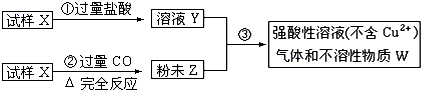
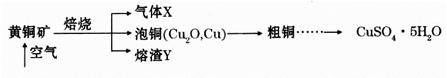


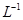 滴定剂EDTA(H2Y2-)标准溶液滴定至终点(滴定剂不与杂质反应),消耗滴定剂b mL。滴定反应如下:
滴定剂EDTA(H2Y2-)标准溶液滴定至终点(滴定剂不与杂质反应),消耗滴定剂b mL。滴定反应如下: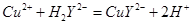 。则CuSO4·5H2O质量分数为__________。滴定管用蒸馏水洗涤后,直接注入标准溶液,则会导致测定结果偏_______。
。则CuSO4·5H2O质量分数为__________。滴定管用蒸馏水洗涤后,直接注入标准溶液,则会导致测定结果偏_______。