题目内容
6.在室温下等体积的酸和碱的溶液,混合后pH一定等于7的是( )| A. | pH=3的硝酸和pH=11的氨水 | B. | pH=3的盐酸和pH=11的氨水 | ||
| C. | pH=3的硫酸和pH=11的KOH | D. | pH=3的醋酸和pH=11的KOH溶液 |
分析 A.硝酸是强电解质、NH3.H2O是弱电解质,pH=3的硝酸浓度小于pH=11的氨水,二者等体积混合,氨水有剩余;
B.HCl是强电解质、NH3.H2O是弱电解质,pH=3的盐酸浓度小于pH=11的氨水,二者等体积混合,氨水有剩余;
C.硫酸和KOH都是强电解质,pH=3的硫酸中c(H+)等于KOH中c(OH-),二者等体积混合,酸碱恰好反应生成强酸强碱盐;
D.醋酸是弱电解质、KOH是强电解质,pH=3的醋酸浓度大于pH=11的KOH浓度,而等体积混合醋酸有剩余.
解答 解:A.硝酸是强电解质、NH3.H2O是弱电解质,pH=3的硝酸浓度小于pH=11的氨水,二者等体积混合,氨水有剩余,NH3.H2O电离程度大于NH4+水解程度,所以混合溶液呈碱性,pH>7,故A错误;
B.HCl是强电解质、一水合氨是弱电解质,pH=3的盐酸浓度小于pH=11的氨水,二者等体积混合,氨水有剩余,NH3.H2O电离程度大于NH4+水解程度,所以混合溶液呈碱性,pH>7,故B错误;
C.硫酸和KOH都是强电解质,pH=3的硫酸中c(H+)等于KOH中c(OH-),二者等体积混合,酸碱恰好反应生成强酸强碱盐,混合溶液呈中性,pH=7,故C正确;
D.醋酸是弱电解质、KOH是强电解质,pH=3的醋酸浓度大于pH=11的KOH浓度,而等体积混合醋酸有剩余,醋酸电离程度大于醋酸根离子水解程度,混合溶液呈酸性,pH<7,故D错误;
故选C.
点评 本题考查混合溶液定性判断,明确强弱电解质电离特点、混合溶液中溶质及其性质是解本题关键,注意AB中NH3.H2O电离程度与NH4+水解程度相对大小,从而确定混合溶液酸碱性,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.下列物质组别,不属于同素异形体的是( )
| A. | 石墨和石墨烯 | B. | O2和O3 | C. | H2O和H2O2 | D. | 单斜硫和斜方硫 |
18.已知白磷跟O2可发生如下反应:P4+3O2═P4O6,P4+5O2═P4O10,某密闭容器中盛有31g白磷和1mol氧气,使之恰好完全反应后,所得到P4O6和P4O10的物质的量之比为( )
| A. | 1:1 | B. | 4:5 | C. | 4:3 | D. | 3:1 |
1.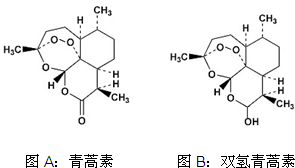 中国女药学家屠呦呦因创制新型抗疟药青蒿素和双氢青蒿素而获得2015年诺贝尔生理学或医学奖.下列有关青蒿素和双氢青蒿素(结构分别为图A、图B)的说法中不正确的是( )
中国女药学家屠呦呦因创制新型抗疟药青蒿素和双氢青蒿素而获得2015年诺贝尔生理学或医学奖.下列有关青蒿素和双氢青蒿素(结构分别为图A、图B)的说法中不正确的是( )
 中国女药学家屠呦呦因创制新型抗疟药青蒿素和双氢青蒿素而获得2015年诺贝尔生理学或医学奖.下列有关青蒿素和双氢青蒿素(结构分别为图A、图B)的说法中不正确的是( )
中国女药学家屠呦呦因创制新型抗疟药青蒿素和双氢青蒿素而获得2015年诺贝尔生理学或医学奖.下列有关青蒿素和双氢青蒿素(结构分别为图A、图B)的说法中不正确的是( )| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 由青蒿素制备双氢青蒿素的反应属还原反应 | |
| C. | 青蒿素分子中含有过氧键和酯基、醚键 | |
| D. | 双氢青蒿素分子中有2个六元环和2个七元环 |
11.将1mol NH3和2mol O2混和,在800℃铂催化剂作用下充分反应,当恢复到常温常压时,所得的产物是( )
| A. | 二氧化氮与氧气 | B. | 硝酸与水 | ||
| C. | 硝酸与一氧化氮 | D. | 一氧化氮与二氧化氮 |
18.下列有关物质用途的说法错误的是( )
| A. | 用Na2O2作潜水艇中O2的来源 | B. | 氢氧化铝可作色素的吸附剂 | ||
| C. | 用铝制餐具长时间存放碱性食物 | D. | 明矾可用作净水剂 |
15.下列递变规律正确的是( )
| A. | 酸性 HF>HCl>HBr>HI | B. | 热稳定性 HI>HBr>HCl>HF | ||
| C. | 单质活动性 F2>Cl2>Br2>I2 | D. | 离子还原性 F->Cl->Br->I- |
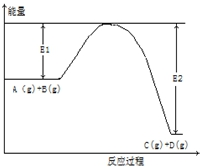 反应A(g)+B(g)?C(g)+2D(g)的能量变化如下图所示,回答下列问题.
反应A(g)+B(g)?C(g)+2D(g)的能量变化如下图所示,回答下列问题.