题目内容
11.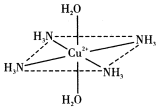 往硫酸铜水溶液中加入氨水,首先生成难溶物,继续加氨水,难溶物溶解,而且所得溶液的颜色比原来明显加深,得到了一种含2+的溶液,此离子的立体结构如图所示(4个NH3与Cu2+共面,跟H2O-Cu2+-H2O轴线垂直).请回答以下问题:
往硫酸铜水溶液中加入氨水,首先生成难溶物,继续加氨水,难溶物溶解,而且所得溶液的颜色比原来明显加深,得到了一种含2+的溶液,此离子的立体结构如图所示(4个NH3与Cu2+共面,跟H2O-Cu2+-H2O轴线垂直).请回答以下问题:(1)硫酸铜水溶液加氨水的变化过程,用离子方程式表示为Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3•H2O=[Cu(NH3)4(H2O)2]2++2OH-+2H2O
①生成浅蓝色沉淀:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+;
②生成深蓝色溶液:Cu(OH)2+4NH3•H2O=[Cu(NH3)4(H2O)2]2++2OH-+2H2O.
(2)此深蓝色的离子属于配离子.其中Cu2+与H2O和NH3形成的是配位键,请在图中表示此化学键.
(3)此深蓝色离子的空间结构呈八面体形.
分析 (1)氨水和硫酸铜反应生成氢氧化铜蓝色沉淀;当氨水过量时,氨水和氢氧化铜反应生成可溶性的铜氨络合物,所以难溶物溶解得到深蓝色的透明溶液,注意根据离子的立体结构可知生成[Cu(NH3)4(H2O)2]2+离子;
(2)配合物中,配位体提供孤电子对,中心原子提供空轨道形成配位键,[Cu(NH3)4(H2O)2]2+中,Cu2+提供空轨道,N、O原子提供孤对电子,据此标出化学键;
(3)4个NH3与Cu2+共面,跟H2O-Cu2+-H2O轴线垂直,每个分子周围紧邻的分子相连接而成的空间几何体为正八面体.
解答 解:(1)氨水和硫酸铜反应生成氢氧化铜蓝色沉淀,离子方程式为:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+,生成浅蓝色沉淀,继续滴加氨水,氨水和浅蓝色氢氧化铜反应生成可溶性的铜氨络合物,根据离子的立体结构可知生成[Cu(NH3)4(H2O)2]2+离子,所以发生的离子反应为:Cu(OH)2+4NH3•H2O=[Cu(NH3)4(H2O)2]2++2OH-+2H2O,生成深蓝色溶液,
故答案为:①Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+②Cu(OH)2+4NH3•H2O=[Cu(NH3)4(H2O)2]2++2OH-+2H2O;
(2)硫酸铜和氨水反应生成氢氧化铜蓝色沉淀,继续加氨水时,氢氧化铜和氨水继续反应,Cu2+提供空轨道,N原子提供孤对电子,生成络合物而使溶液澄清,[Cu(NH3)4(H2O)2]2+为配离子,Cu2+提供空轨道,N、O原子提供孤对电子,则以配位键结合,此化学键可表示为: ,
,
故答案为:配离子;配位; ;
;
(3)[Cu(NH3)4(H2O)2]2+为配离子,4个NH3与Cu2+共面,跟H2O-Cu2+-H2O轴线垂直,铜离子的配位数是6,将6个分子连接后所围成的空间几何构型正八面体,
故答案为:八面体.
点评 本题考查了配合物、配位键的形成等性质,题目难度中等,明确形成配合物的条件是:有提供空轨道的中心原子,有提供孤电子对的配位体.注意配位键属于共价键,注意铜离子的化学性质.

①“PM2.5”是细小颗粒物悬浮在空气中形成胶体,严重危害人体健康
②纯碱既属于正盐又属于钠盐和碳酸盐
③相同温度下,氢氧化钠溶液的导电能力与氨水溶液强
④丁达尔效应可用于区别溶液和胶体,烟、云、雾均为胶体,能产生丁达尔效应.
⑤钢铁的吸氧腐蚀,负极发生反应:Fe-2e-═Fe2+.
| A. | ①②④⑤ | B. | ②③④ | C. | ②④⑤ | D. | ③④⑤ |
| A. | 人类目前所直接利用的能量全部是由化学反应产生的 | |
| B. | 化学反应不一定伴随着能量变化 | |
| C. | 化学变化中的能量变化主要是由化学键变化引起的 | |
| D. | 化学反应中能量变化的大小与反应物质量的多少无关 |
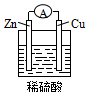
| A. | 铜片是负极 | B. | 氢离子在铜片表面被还原 | ||
| C. | 电流从锌片经导线流向铜片 | D. | 铜片质量逐渐减少 |
 )可用作航空燃料的防震剂、橡胶工业防震剂等.1mol茚满与氧气、氢气反应,最多消耗氧气和氢气的物质的量之比是( )
)可用作航空燃料的防震剂、橡胶工业防震剂等.1mol茚满与氧气、氢气反应,最多消耗氧气和氢气的物质的量之比是( )| A. | 23:3 | B. | 3:23 | C. | 23:6 | D. | 6:23 |
| 选项 | A | B | C | D |
| 实验样品 | Na2CO3 | 氯水 | NaCl固体 | 乙醇 |
| 实验数据 | 5.26mL | pH=2.3 | 10.3g | 78.3℃(沸点) |
| 实验仪器 | 酸式滴定管 | 广泛pH试纸 | 托盘天平 | 体温计 |
| A. | A | B. | B | C. | C | D. | D |
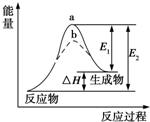
| A. | 该反应的反应热△H=E2-E1 | |
| B. | 催化剂能改变反应的焓变 | |
| C. | 催化剂能降低反应的活化能 | |
| D. | a、b分别对应无催化剂和有催化剂的能量变化 |
 某学习小组依据氧化还原反应:2Ag++Cu═Cu2++2Ag设计成的原电池如图所示,则负极发生的电极反应为Cu-2e-═Cu2+;当反应进行到一段时间后取出电极材料,测得某一电极增重了5.4g,则该原电池反应共转移了的电子数目是0.05NA.
某学习小组依据氧化还原反应:2Ag++Cu═Cu2++2Ag设计成的原电池如图所示,则负极发生的电极反应为Cu-2e-═Cu2+;当反应进行到一段时间后取出电极材料,测得某一电极增重了5.4g,则该原电池反应共转移了的电子数目是0.05NA.