题目内容
5.下列关于有机化合物的结构、性质的叙述正确的是( )| A. | 糖类、油脂、蛋白质的水解产物都是非电解质 | |
| B. | 淀粉和纤维素的分子式均为(C6H10O5)n,二者互为同分异构体 | |
| C. | 纤维素、甘油分别在浓硫酸存在时与浓硝酸的反应属于同一类型的反应 | |
| D. | 乙醇、乙酸和苯酚的分子中均含有官能团-OH,所以均能与NaOH溶液反应 |
分析 A.糖类、油脂、蛋白质及水解产物葡萄糖、甘油均为非电解质,而水解产物高级脂肪酸、氨基酸均为电解质;
B.淀粉和纤维素的分子式均为(C6H10O5)n,但n不同;
C.由纤维素制硝酸纤维为取代反应,甘油生成硝化甘油为取代反应;
D.乙醇与NaOH不反应.
解答 解:A.油脂水解生成的高级脂肪酸及蛋白质水解生成的氨基酸均为电解质,故A错误;
B.淀粉和纤维素的分子式均为(C6H10O5)n,但n不同,二者不是同分异构体,故B错误
C.纤维素、甘油分别在浓硫酸存在时与浓硝酸的反应,反应类型均为取代反应,故C正确;
D.乙醇、乙酸和苯酚的分子中均含有官能团-OH,乙酸、苯酚均能与NaOH溶液,而乙醇不能,故D错误;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机反应为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
13. 常温时,向20mL0.1mol/L的HR溶液中滴加0.1mol/LNaOH溶液,溶液的pH与滴加NaOH体积V的关系如图所示,下列说法正确的是( )
常温时,向20mL0.1mol/L的HR溶液中滴加0.1mol/LNaOH溶液,溶液的pH与滴加NaOH体积V的关系如图所示,下列说法正确的是( )
 常温时,向20mL0.1mol/L的HR溶液中滴加0.1mol/LNaOH溶液,溶液的pH与滴加NaOH体积V的关系如图所示,下列说法正确的是( )
常温时,向20mL0.1mol/L的HR溶液中滴加0.1mol/LNaOH溶液,溶液的pH与滴加NaOH体积V的关系如图所示,下列说法正确的是( )| A. | HR为强电解质 | |
| B. | 图中四点,水的电离程度:c>b>d>a | |
| C. | 若常温时,0.1mol/LHR溶液的电离度为1%,则常温时R+的水解常数约为10-9 | |
| D. | b点溶液中存在c(Na+)=c(R+)+c(HR) |
20.用相对分子质量为57的烷基取代甲苯苯环上的一个氢原子所得芳香烃产物的数目有( )
| A. | 3种 | B. | 4种 | C. | 6种 | D. | 12种 |
17.用HNO3和HF的混酸处理某金属后,产生的酸洗废液中含有Fe3+、Ni2+、NO3-、F-和Cr2O72-等.下图是综合利用该酸洗废液的工艺流程:
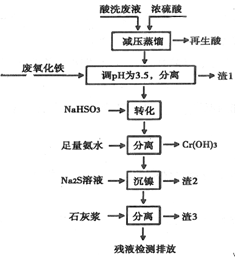
已知:
①金属离子开始沉淀和沉淀完全时的pH:
②Ni2+与足量氨水的反应为:Ni2++6NH3?[Ni(NH3)6]2+
(1)再生酸中含有HNO3,采取减压蒸馏的目的为降低蒸馏的温度以减少硝酸的分解.
(2)滤渣1的主要成分为:Fe(OH)3和少量氧化铁.
(3)“转化”时NaHSO3与Cr2O72-发生反应的氧化剂与还原剂的物质的量之比:1:3.
(4)已知[Ni(NH3)6]2+为难电离的络合离子,则“沉镍”的离子方程式为:[Ni(NH3)6]2++S2-=NiS↓+6NH3.
(5)滤渣3的主要成分为CaSO4、Ca(OH)2和CaF2.
(6)经检测,最后的残液中c(Ca2+)=0.001mol•L-1,则残液中F-浓度为3.8
Mg•L-1,符合(填“符合”或“不符合”)排放标准[已知Ksp(CaF2)=4×10-11,国家排放标准要求氟离子浓度小于10mg•L-1].

已知:
①金属离子开始沉淀和沉淀完全时的pH:
| Fe3+ | Ni2+ | Cr3+ | |
| 开始沉淀 | 1.5 | 6.7 | 4.0 |
| 沉淀完全 | 3.4 | 9.5 | 6.9 |
(1)再生酸中含有HNO3,采取减压蒸馏的目的为降低蒸馏的温度以减少硝酸的分解.
(2)滤渣1的主要成分为:Fe(OH)3和少量氧化铁.
(3)“转化”时NaHSO3与Cr2O72-发生反应的氧化剂与还原剂的物质的量之比:1:3.
(4)已知[Ni(NH3)6]2+为难电离的络合离子,则“沉镍”的离子方程式为:[Ni(NH3)6]2++S2-=NiS↓+6NH3.
(5)滤渣3的主要成分为CaSO4、Ca(OH)2和CaF2.
(6)经检测,最后的残液中c(Ca2+)=0.001mol•L-1,则残液中F-浓度为3.8
Mg•L-1,符合(填“符合”或“不符合”)排放标准[已知Ksp(CaF2)=4×10-11,国家排放标准要求氟离子浓度小于10mg•L-1].
14.在体积为1L密闭容器中充入3mol的H2和1mol的N2,经测定反应开始后3s末的v(H2)=0.3mol/(L•s),则3s末H2的浓度为( )
| A. | 0.9mol/L | B. | 1.8mol/L | C. | 2.1mol/L | D. | 1.2mol/L |
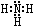 ;B分子也由Z、X两元素组成,作为运送飞船的火箭燃料,常温下是一种液态化合物.已知该化合物的相对分子质量为32,其中X元素的质量分数为12.5%,且该分子结构中只有单键.则B的结构式为
;B分子也由Z、X两元素组成,作为运送飞船的火箭燃料,常温下是一种液态化合物.已知该化合物的相对分子质量为32,其中X元素的质量分数为12.5%,且该分子结构中只有单键.则B的结构式为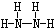 .若64g B分子与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,还放出3000kJ的热量,写出该反应的热化学方程式N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-1500kJ/mol.
.若64g B分子与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,还放出3000kJ的热量,写出该反应的热化学方程式N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-1500kJ/mol.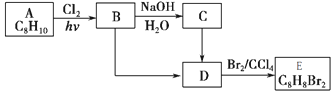
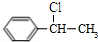 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$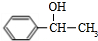 +NaCl
+NaCl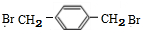 (填结构简式).
(填结构简式).
 .
. .
. +
+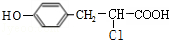 $→_{△}^{催化剂}$
$→_{△}^{催化剂}$ +HCl.
+HCl.